Разумовский а ю пластика пищевода толстой кишкой. Толстокишечная пластика пищевода. Подготовка к операции
Далеко не у всех больных особенности строения кишечника и брыжейки позволяют выделить и мобилизовать достаточно длинную петлю тонкой кишки. Более подходящей является толстая кишка, правая или левая половина которой легко и без нарушений кровоснабжения выводится на шею и может быть соединена непосредственно с пищеводом, а при необходимости даже с глоткой. Лучше использовать правую половину с отрезком подвздошной кишки. Операция проста, безопасна и обеспечивает изоперистальтическое положение трансплантата. Разрез срединный, заходящий немного ниже пупка. Сегмент для пластики выбирают после тщательного изучения основных артериальных стволов и сосудистых анастомозов по всей длине толстой кишки. Если решено использовать ее правую половину, то рассекают брюшину под слепой кишкой и в правом боковом канале. Отступя от слепой кишки к корню брыжейки на 10-12 см, перевязывают ствол а. ileocolica ниже места деления. Питание мобилизованной петли сохраняется за счет a. colica media. Затем пересекают между зажимами и перевязывают сосуды брыжейки ileum terminale с таким расчетом, чтобы получить свободный ее отрезок длиной 15-20 см. Тонкую кишку пересекают и зашивают отводящий ее конец наглухо. Освободив слепую, восходящую и печеночный угол толстой кишки, сохраняя a. colica media, перемещают трансплантат на шею под кожей или ретростернально (рис. 61) так, чтобы отрезок тонкой кишки, выходя на шею, отходил влево, а не вправо, иначе нарушится проходимость. Поперечную кишку пересекают на уровне желудка, не перевязывая брыжеечные сосуды. Накладывают илео-трансверзальный анастомоз между приводящим концом подвздошной и отводящим толстой кишки конец в бок или конец в конец. Центральный же конец последней (то есть трансплантата) соединяют с желудком конец в бок обычно выше имеющейся гастростомы.
Для создания пищевода из левой половины толстой кишки рассекают париетальную брюшину в левом боковом канале и мобилизуют селезеночный угол. Лигируют а. colica sinistra и сигмовидные артерии ниже их развилки. Затем пересекают сигмовидную кишку, приводящий ее конец зашивают и выводят петлю на шею в антиперистальтическом направлении. Трансплантат анастомозируют с желудком как можно выше, в области дна последнего. Иногда при ожоге желудка и рубцевании его стенок толстую кишку вшивают в здоровую часть двенадцатиперстной кишки или в начальную петлю тощей кишки. Наложение пищеводно-кишечного соустья на шее откладывают на несколько дней.
Пищевод из толстой кишки, особенно загрудинный, функционирует хорошо. Однако, из-за отсутствия замыкающего механизма в трансплантате из левой половины толстой кишки, у некоторых больных, особенно в лежачем положении, возникает регургитация пищи (обратное выбрасывание ее в рот). При пластике из правой половины толстой кишки с отрезком тонкой этого никогда не бывает, так как в систему искусственного пищевода включается илео-цекальная (баугиниева) заслонка. Отдаленные результаты толстокишечной пластики пищевода вполне благоприятные.
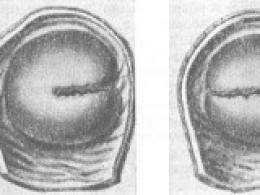
Рис. 61. Операции создания искусственного пищевода из правой половины толстой кишки с отрезком тонкой; вид законченной операции: внизу слева-образование отрезка поперечной ободочной и тонкой кишок.
При патологиях пищевого канала специалисты назначают лечение пищевода. Это непростая задача, так как лечебные мероприятия должны быть комплексными и включать в себя лечение медикаментами, физиотерапию, диету, в тяжелых случаях используются хирургический подход.
Основная цель лечения – это уменьшение симптомов болезни и увеличение срока ремиссии.
Существует несколько схем, каждая подбирается с учетом индивидуальности пациента, опираясь на диагностические методы. Хороший дополнительный результат как помощь к основному лечению оказывает народная медицина. Давайте подробнее рассмотрим чем лечить пищевод.
Основной курс при неэрозивной стадии продолжается 1 месяц. Ингибиторы помпы или ИПП принимаются один раз в день. При эрозивном поражении лечение длится 2 месяца, ИПП пациент употребляет два раза в день. Дозировку назначает лечащий врач в зависимости от тяжести воспаления.
Препараты для лечения пищевода следующие:

После того, как оканчивается основной лечебный курс, пациент продолжает принимать поддерживающую терапию. Это одновременно является профилактикой , так как при отсутствии лечения только у 25% пациентов ремиссия сохраняется на срок более полугода. Большинство из пациентов пьют медикаментозные препараты всю оставшуюся жизнь, чтобы снизить риск возникновения онкологии пищеводной трубки.

Как лечить пищевод: схемы терапии
Пациентам требуются:
- Терапия проходит с назначением одного и того же лекарства. При таком лечении не учитываются яркость симптомов, изменение мягких тканей, осложнения. Такой подход малоэффективен, при тяжелых формах может нанести вред здоровью.
- Терапия с усилением – пациенту назначают разные лекарства с различной степенью агрессивности на определенных этапах воспаления, . Когда желаемого результата не происходит, врач комбинирует похожие медикаменты, но с более сильным воздействием.
- При третьей схеме больной принимает блокаторы протонного насоса с сильным действием. Когда яркие признаки стихают, используются прокинетики со слабым действием. Это схема оказывает влияние на здоровье с лучшим эффектом, применяется для лечения рефлюксной болезни тяжелой степени.
Медикаментозное лечение должно быть двухступенчатым. На первом этапе приходит в норму слизистая оболочка, второй этап помогает увеличить продолжительность ремиссии. Второй подход выбирается вместе с больным по его желанию для его же удобства.

Продолжительность лечения медикаментами и количество дозировки будет зависеть от тяжести воспаления. Обычно врач назначает два средства из разных групп. Комбинируются прокинетики , антациды , антисекреторные средства . Здоровый образ жизни, соблюдение диеты, режима питания помогает достичь успешного результата за более короткий промежуток времени.
Хирургия пищевода при рефлюкс эзофагите
Не стоит пользоваться запросом типа специалист хирургия пищевода германии, поскольку отечественная медицина и ее возможности находятся на достойном уровне. Хирургическая операция при рефлюкс-эзофагите делается лапароскопом без разрезов. Из желудка хирург формирует специальную манжетку, которая препятствует рефлюксу. Такой подход полностью излечивает больных при рефлюкс-эзофагите.
Показания к операции:

Подходит для тех больных, у которых наблюдается тяжелое течение ГЭ рефлюксной болезни. Как правило, запущенные стадии лечится лекарствами неэффективно, пересмотр рациона также не дает результата.
При этом пациенты избавляются от пожизненного приема лекарственных препаратов. По окончании реабилитации человек ощущает значительное улучшение, сфинктер работает в нормальном режиме.
Решение об операции принимает гастроэнтеролог после консультации с хирургом, диетологом. По необходимости собирается консилиум со всеми специалистами.
Удаление пищевода с последующей пластикой
Это оперативное вмешательство проходит со вскрытием брюшной и грудной полости, прогноз неблагоприятный. Операция делается при онкологии или других опасных поражениях.

После полного удаления пищеводной трубки (процедура называется экстирпация пищевода), ее замещают искусственным образом, трансплантат делается:
- из трубчатого лоскута желудка, который формируют из большой кривизны;
- используют для этого петли кишечника;
- искусственный пищевод создают сразу или же спустя какое-то время после первой операции.
При новейших технологиях операция имеет лучший прогноз, она меньше травматична, занимает короткий промежуток времени. Манипуляция выполняется через подкожный тоннель специальным инструментарием. Пищевод отсекается через разрез на шее и небольшой разрез в эпигастральной области. Через этот туннель вводится искусственный пищевод из петли тонкого кишечника, подшивается. Возможна пластика пищевода толстой кишкой.
Резекция пищевода
Эта радикальная операция по удалению участка пищеводного канала проводится при кардиоспазме , при опухолях, дивертикулах (), грыжах , врождённых патологиях. Одновременно с этим формируется искусственный пищевод, это избавляет больного от повторной восстановительной пластики.
Паллиативная хирургия
Паллиативные операции могут выполняться традиционным способом, лапароскопическим и эндоскопическим методом. В первой ситуации доступ каналу осуществляется путём непосредственного вскрытия грудной, брюшной полости. Метод осуществляет хороший доступ к органу, но опасен последствиями в постоперационной стадии.
- наложение гастростомы;
- склеротерапия вен.

Лигирование варикоза пищеводного канала
Что значит легирование пищевода? На фоне цирроза печени, вирусных гепатитов, хронического алкоголизма происходит перестройка сосудистого русла, кровяное давление в портальной вене увеличивается, кровоток перераспределяется. При этом вены пищеводного канала становятся расширенными, извилистыми, стенки могут спадаться, выпячиваться в просвет канала.
Такое состояние вызывает риск возникновения кровотечения внутри пищевода – это самый опасный признак портальной гипертензии.
Путём введения фиброэзофагоскопа производится лигирование и склерозирование пищеводных сосудов.
- аппарат с насадками вводится через рот, достигает просвета пищеводного канала, на экране монитора доктор видит измененные сосуды;
- затем при помощи отсоса варикозные участки прикрепляются к насадке, на них надевается кольцо из латекса.
В процессе образуются синюшные шарики, которые отпадают концу первой недели. Затем лигатуры выводятся из организма естественным путем. После опадания лигатуры образуется язвенная поверхность, она эпителизируется в течение 15-20 дней.

Эндоскопические процедуры
Делаются для того, чтобы удалить доброкачественные опухоли, полипы, для прижигания лазером, для воздействия жидким азотом. Эзофагоскопии вводят через рот, он имеет специальные петли, щипцы, электроды. При помощи этого метода также берут кусочек ткани для последующего гистологического исследования.
Полезное видео
Мы разобрались с вопросами как вылечить пищевод, и какой врач лечит пищевод. Информация, предоставленная в этом видео, также будет полезной.
Значение диеты
Как будет протекать постоперационный период, зависит от пациента, от соблюдения врачебных рекомендаций, где важная роль принадлежит рациону. Диета выбирается в индивидуальном порядке, зависит от характера вмешательства. Полноценный рацион должен содержать много белка, нормальное количество жира.
Характеристика рациона:

Должны быть исключены все виды алкоголя, шоколад, мороженое, не рекомендуются консервы, копченая колбаса, мясные и рыбные полуфабрикаты. Пациент не должен употреблять маринады, острые приправы, копченые и соленые продукты. Также исключается лук, редис, чеснок, грибы, щавель. Кислые сорта фруктов и ягод также не стоит включать в рацион: придётся отказаться от лимонов, яблок, крыжовника, смородины, вишни.
Основанием для применения толстокишечной пластики пищевода является необходимость создания трансплантата большой длины. Э. Н. Ванцян и Р. А. Тощаков (1971) показали, что толстокишечный трансплантат по сравнению с тонкокишечным менее чувствителен к нарушениям микроциркуляции и оксигенации. Морфологические изменения трансплантата из толстой кишки при его функционировании в качестве пищевода выражаются в пролиферации бокаловидных стенок желез, перестройке сосудов подслизистого слоя. Весь отрезок толстой кишки, расположенный между слепой кишкой и прямой, обозначается одним общим названием — ободочная кишка.
В последней различают восходящую ободочную кишку, поперечную ободочную кишку, нисходящую ободочную кишку и сигмовидную кишку. По данным F. Treves (1885), у мужчин длина толстой кишки равна в среднем 136 см, а у женщин — 132 см. Для формирования искусственного пищевода обычно используют участок кишки длиной 40—60 см.
Ободочная кишка получает артериальные ветви из двух сосудистых магистралей — верхней и нижней брыжеечных артерий. Верхняя брыжеечная артерия посылает к ободочной кишке подвздошно-ободочную, правую ободочную и среднюю ободочную артерии. Нижняя брыжеечная артерия отдает ободочной кишке левую ободочную и сигмовидные артерии. Конечной ее ветвью является верхняя прямокишечная артерия. Наиболее крупным анастомозом между верхней и нижней брыжеечной артериями является дуга Риолана, образованная левой ветвью средней ободочной артерии и восходящей ветвью левой ободочной артерии.
Экстраорганные вены толстой кишки представляют собой венозные магистрали, сопровождающие обычно одноименные артериальные стволы и их разветвления, принадлежащие к системе верхней и нижней брыжеечных вен и отводящие кровь в воротную вену. При формировании искусственного пищевода необходимо учитывать особенности строения как артериальной, так и венозной системы в каждом конкретном случае, так как жизнеспособность трансплантата полностью зависит от индивидуальных особенностей сосудов брыжейки [Шалимов А. А. и др., 1975].
Для создания искусственного пищевода может быть использована правая или левая половина толстой кишки, которая располагается в изо- и антиперистальтическом направлении (смотрите рисунок ниже).
а-места перевязки и пересечения сосудов при пластике правой половиной толстой кишки (1) поперечной ободочной кишкой (2 и 3), левой половиной толстой кишки, (4); б - по Лафаргу; в-поперечной ободочной кишкой; г – по Скенлону и Стеили, д – по Шалимову. Схема.
«Ожоги пищевода и их последствия»,
Г.Л.Ратнер, В.И.Белоконев
а) Показания к пластике пищевода толстой кишкой за грудиной . Размещение толстой кишки за грудиной для реконструкции или шунтирования пищевода применяют очень редко. Толстая кишка может быть расположена субстернально, если у больного уже был удалён пищевод, но его реконструкция не удалась. В такой ситуации бывает необходимо разместить трансплантат в стороне от первоначального ложа пищевода.
В редких случаях при раке пищевода предпочтительна паллиативная операция без выполнения эзофагэктомии. Больные с трахеопищеводными свищами обычно неизлечимы. Попытки удаления пищевода почти всегда ставят перед хирургом неизбежную проблему пластики дефекта трахеи или бронха.
Кроме того, паллиативная операция без удаления пищевода показана и больным без трахеопищеводных свищей, имеющим несомненные признаки врастания злокачественной опухоли в трахею, выявленные при бронхоскопии. У таких больных может быть полная обтурация пищевода опухолью, а при наличии трахеопищеводного свища - повторные аспирации пищевых масс с развитием пневмонии.
Им можно выполнить паллиативную операцию - шунтирование пищевода частью толстой кишки, помещённой за грудиной. Эта операция ликвидирует дисфагию и позволяет больному принимать пищу и пить.
б) Техника и этапы реконструкции пищевода толстой кишкой за грудиной . Больных, подвергающихся операции шунтирования пищевода, укладывают на операционный стол навзничь, им обрабатывают и обкладывают стерильным бельём переднюю поверхность груди и живота. Голову больного поворачивают направо. Выполняют широкую срединную лапаротомию. Подготавливают длинный трансплантат из сегмента толстой кишки, который будет служить шунтом пищевода.
В трансплантат входит большая часть поперечной ободочной кишки , селезёночный угол и большой участок нисходящей ободочной кишки, кровоснабжаемые из общего притока - восходящей ветви левой толстокишечной артерии. Отделяют сальник от поперечной ободочной кишки, мобилизуют из забрюшинного пространства левую половину толстой кишки. Хирург может рассчитать точки пересечения правой половины поперечной и нисходящей ободочной кишки и затем измерить длину толстокишечного трансплантата пупочной тесьмой.
Вычисляют адекватную длину толстой кишки : трансплантат должен достигать шеи с некоторым избытком. Жизнеспособность трансплантата, определяющаяся кровотоком по восходящей ветви левой толстокишечной артерии, можно проверить, наложив зажим «бульдог» на основание срединной толстокишечной артерии и краевую артерию проксимально и дистально от предполагаемых мест пересечения кишки. После того, как хирург убедится в жизнеспособности трансплантата, он пересекает между двумя зажимами краевые артерии на его концах.

Кроме того, лигирует и пересекает среднюю толстокишечную артерию проксимальнее её бифуркации. Брыжейку поперечной ободочной кишки рассекают вплоть до восходящей ветви левой толстокишечной артерии.
Мобилизацию трансплантата из длинного сегмента ободочной кишки завершают освобождением селезёночного угла. После этого толстую кишку разделяют проксимально и дистально при помощи линейного степлера.
Если у больного ранее не использовали доступ на шее , проводят криволинейный разрез, начинающийся на 1 см выше яремной вырезки грудины и продолжающийся влево, над средней частью грудиноключично-сосцевидной мышцы. В косметическом отношении он выгоднее, чем разрез по переднему краю грудино-ключично-сосцевидной мышцы. Рассекают подкожную мышцу шеи, отсепаровывают её края по периферии разреза на глубину около 1 см. Лопаточно-подъязычную мышцу (m. omochyoideus) и среднюю щитовидную вену пересекают.

Ранорасширителем отодвигают трахею и щитовидную железу медиально, а грудино-ключично-сосцевидную мышцу - латерально, остерегаясь излишнего натяжения возвратного гортанного нерва или влагалища сонной артерии. Пищевод с введённым в него зондом легко обнаружить при пальпации. Пищевод выделяют по окружности и захватывают зажимом Бебкокка. Выделять пищевод следует осторожно, чтобы не повредить возвратные гортанные нервы. Для обведения шейного отдела пищевода используют малый дренаж Пенроуза.
Если у больного уже сформирована эзофагостома , её выделяют из окружающих тканей и разводят края предыдущей раны на шее. Проводят диссекцию вглубь до превертебральной фасции.
После этого создают подгрудинный туннель . Внизу, после иссечения мечевидного отростка, хирург легко проникает в пространство по краю надкостницы задней поверхности грудины. Это пространство заполнено только рыхлой клетчаткой, потому в нём можно создать туннель, поднимаясь снизу вверх, вдоль надкостницы задней поверхности грудины. Перфорации плевры при этом, как правило, не происходит. Если левое грудино-ключичное соединение слишком выступает, может понадобиться срезать его костными кусачками или ножом Lebske, чтобы оно не сдавило толстокишечный трансплантат.

После того, как канал будет сделан , к проксимальному концу трансплантата одиночными швами шёлком № 2/0 фиксируют торакальную дренажную трубку размером 32 Fr. Это облегчит проведение длинного сегмента толстой кишки по субстернальному пространству. Торакальный дренаж проводят снизу в загрудинном пространстве и захватывают сверху. Затем трансплантат, фиксированный к дренажной трубке, осторожно протягивают на шею. При подтягивании толстокишечного трансплантата он должен проходить позади желудка. Таким образом, впоследствии питающая сосудистая ножка трансплантата ложится сзади от желудка.
Трудностей при формировании трансплантата адекватной длины быть не должно. Пищевод пересекают линейным степлером чуть выше верхней апертуры грудной клетки. Толстая кишка должна удобно лечь в ране на шее, после чего без натяжения накладывают эзофагоколоанастомоз «конец в конец». Анастомоз создают двумя рядами одиночных узловых швов шёлком № 3/0. Наружный ряд швов по задней поверхности соустья создают до вскрытия просвета пищевода. Удаляют линии скобок как с пищевода, так и с кишки. Накладывают внутренний ряд швов по задней поверхности соустья, проводя шёлковые лигатуры № 3/0 насквозь через стенки пищевода и толстой кишки.
Прежде чем приступить к швам на передней стенке анастомоза , продвигают назогастральный зонд из пищевода в кишку. Позднее его конец будет находиться в желудке. Внутренний ряд отдельных узловых швов по передней стенке соустья делают шёлком № 3/0, вкалывая иглу изнутри кнаружи на кишке и снаружи внутрь на пищеводе. Наружный ряд по передней стенке анастомоза представлен серией ламберовских швов из шёлка № 3/0.

Следующий этап операции - кологастростомия по задней поверхности тела желудка. Прежде чем приступить к наложению дистального анастомоза, необходимо иссечь избыточную длину толстокишечного трансплантата. Между ним и желудком накладывают стандартное соустье двухрядными швами: наружным рядом - из одиночных узловых швов, внутренним - непрерывным швом. Сначала создают наружный ряд швов по задней стенке анастомоза (швы Ламбера, одиночные узловые шёлком № 3/0).
Электроножом иссекают линию скобок на толстой кишке и формируют отверстие на желудке. Внутренний непрерывный герметизирующий шов по задней стенке анастомоза делают синтетической рассасывающейся нитью № 3/0.

Его продолжают как внутренний шов по передней стенке анастомоза по способу Connell . Перед закрытием внутреннего шва передней стенки соустья назогастральный зонд продвигают из дистального отдела толстокишечного трансплантата в желудок. Кологастростомию завершают наложением наружного ряда ламберовских швов по передней стенке шёлком № 3/0. Завершённый шунт проходит в грудной клетке за грудиной и позади желудка в брюшной полости.
Целостность ободочной кишки восстанавливают колоколостомией. Правую половину поперечной ободочной кишки и дистальную часть нисходящей ободочной соединяют стандартным двухрядным анастомозом. Как правило, последний может быть наложен выше корня брыжейки толстой кишки при условии выделения правой половины толстой кишки из забрюшинного пространства и мобилизации сигмовидной кишки. Если концы кишки не удаётся свести без натяжения, тогда необходимо провести расширенную мобилизацию восходящей ободочной кишки и повернуть её вниз, после чего наложить анастомоз ниже корня брыжейки тонкой кишки.
Существует несколько вариантов проведения шунта за грудиной и выключения грудного отдела пищевода . Если остался на обычном месте и был выключен из пассажа пищи, возможно (хотя и очень редко), что изолированный его сегмент между шеей и обтурирующей опухолью прорвётся по проксимальной линии скобок и разовьётся медиастинит. Исходя из этих соображений, в проксимальный отдел пищевода через кисетный шов (шёлк № 3/0) можно провести узкий катетер. Катетер выводят на шею и оставляют для декомпрессии пищевода.

Хирург также может перевязать место перехода пищевода в желудок куском пупочной тесьмы, что особенно важно при наличии пищеводно-трахеального свища. Такой манёвр предотвращает рефлюкс желудочного содержимого в проксимальный отдел пищевода, чреватый попаданием пищи через трахеопищеводный свищ в лёгочное дерево. Если хирург выполняет перевязку пищеводно-желудочного соединения, он должен отделить блуждающие нервы от пищевода и сохранить их, а тесьму провести под ними.
Достаточная длина, хорошее кровоснабжение, возможность получить прямой, без лишних петель, трансплантат без существенных функциональных нарушений для организма - вот основные факторы, которые привели к широкому распространению толстокишечной эзофагопластики.
В настоящее время для создания искусственного пищевода используют как правую, так и левую половины толстой кишки в различных модификациях. Приводим применяемые методики создания искусственного пищевода из толстой кишки.
Первую попытку осуществить толстокишечную эзофагопластику предпринял в 1911 г. Kelling у больной, страдающей непроходимостью пищевода вследствие злокачественной опухоли. В связи с неблагоприятными условиями мобилизации тонкой кишки Келлинг использовал для пластики поперечную ободочную кишку. Для этого он пересек поперечную ободочную кишку у селезеночного и печеночного углов, проксимальный конец трансплантата зашил наглухо, а дистальный - анасто- мозировал с передней стенкой желудка на уровне его дна. Непрерывность толстого кишечника была восстановлена анастомозом конец в конец. Проксимальный конец мобилизованной поперечной ободочной кишки был перемещен под кожу передней поверхности грудной клетки слева от грудины до уровня сосков, где просвет кишки был вскрыт и сформирован толстокишечный свищ. Питание больной осуществлялось с помощью гастростомы по Кадеру. Через 25 дней был сформирован пищеводный свищ на шее и оба свища соединены при помощи кожной трубки (рис. 247). В послеоперационном периоде на месте кожнопищеводного соустья возникли свищи. Закрыть их окончательно не удалось, так как больная погибла при явлении раковой кахексии. Операция стала прототипом изоперистальтической толстокишечной эзофагопластики.
 Два месяца спустя после публикации Kel- ling лозанский хирург Vuillet опубликовал результаты выполненных им на трупах иссле
Два месяца спустя после публикации Kel- ling лозанский хирург Vuillet опубликовал результаты выполненных им на трупах иссле
дований, посвященных возможности использования толстой кишки для создания искусственного пищевода. Он пересекал толстую кишку на уровне печеночного и селезеночного углов. Мобилизовал на сосудистой ножке левую половину трансплантата, в результате чего его общая длина достигала 32-40 см. Затем печеночный конец толстокишечного трансплантата вшивали в переднюю стенку желудка, а селезеночный - проводили на переднюю поверхность груди до уровня шеи, т. е. трансплантат располагали антиперистальтически (рис. 248).
Работы Kelling и Vuillet заложили основу дальнейшей разработки толстокишечной эзо- фагопластики, как изоперистальтической (по Келлингу), так и антиперистальтической (по Вюйе). В клинике толстокишечную эзофаго- пластику с кожной надставкой осуществили Marvedel (1913), Hacker (1914), Lundbland (1821), О. А. Стукей (1917) и др.
Roith в 1924 г. описал выполненную им в 1919 г. толстокишечную эзофагопластику за счет правой половины ободочной кишки. Подвздошная кишка была отсечена у слепой, культя ее была ушита наглухо. Поперечную ободочную кишку Roith пересек справа от средней линии. Питание мобилизованной кишки осуществлялось за счет средней ободочной артерии (рис. 249). Дистальный конец толстокишечного трансплантата был соединен с желудком, слепая кишка проведена подкожно на шею и соединена с пищеводом. Операция была выполнена в один момент.
В 1951 г. Lafargue с соавторами (1951) предложили с целью удлинения включать в состав трансплантата из правой половины толстой кишки участок подвздошной кишки с питанием трансплантата за счет средней ободочной артерии (рис. 250). Операция успешно выполнена у 2 больных. Мобилизованную кишку проводили изоперистальтически подкожно на шею, где анастомозировали с пищеводом. Дистальный конец трансплантата соединяли с желудком. Lortat-Jacob (1951) использовал данную методику для пластики пищевода после резекции его по поводу рака. Толстокишечный трансплантат был проведен через заднее средостение на шею, где и был соединен с пищеводом. Дистальный конец трансплантата был соединен с тощей кишкой. Rudler и Monod-Broca (1951) наложили обходной анастомоз в случае неоперабельного рака пищевода, используя правую половину


толстой кишки с участком подвздошной кишки, проводя трансплантат загрудинно. Maccas (1953) выполнил аналогичную операцию при рубцовом сужении пищевода. В СССР эту операцию первыми начали применять Б. А. Петров и П. И. Андросов.
Техника этой операции следующая. Положение больного на спине с подложенным под нее валиком. Брюшную полость вскрывают срединным разрезом на 1,5-1 см выше мечевидного отростка, обходя его слева от пупка и далее обходя его справа и ниже еще на 6- 8 см. После ревизии брюшной полости осматривают все отделы толстого кишечника, предварительно определяют пригодность правой половины толстой кишки для замещения пищевода, приступают к ее мобилизации. Для этого петли тонкой кишки покрывают влажным полотенцем и отводят вместе со слепой кишкой и восходящим отделом толстой кишки влево и кверху.
Затем рассекают париетальную брюшину под слепой кишкой и по наружному краю восходящего отдела тонкой кишки. Тупо отделяют кишку от забрюшинной клетчатки, выводят в рану. Рассекают переходную складку брюшины. Кишку в области печеночного угла оттягивают кнутри, а забрюшинную клетчатку расслаивают тупым и острым путем до места отхождения основных сосудов толстой кишки от верхней брыжеечной артерии. Затем отсекают большой сальник от поперечной ободочной кишки начиная в бессосудистой части. В области печеночной кривизны ободочной кишки пересекают правую диафрагмальноободочную связку. Перед выкраиванием трансплантата нужно изучить особенности строения основных сосудов - подвздошно-ободочной, правой ободочной и средней ободочной артерией и вен, связей между ними и особенно выраженность краевого сосуда. Измеряют длину подлежащего мобилизации трансплантата и сравнивают с расстоянием от верхнего края брыжейки поперечной ободочной кишки до угла нижней челюсти при предгрудинном и загрудинном расположении трансплантата и до ключицы - при внутриплевральном его расположении. Нередко удается использовать даже для тотальной эзофагопластики только
правую половину толстой кишки с питанием трансплантата за счет средней ободочной артерии даже без включения сегмента подвздошной кишки. Однако наиболее часто при тотальной эзофагопластике, когда расстояние от угла нижней челюсти больше длины мобилизованной правой половины толстой кишки с питанием за счет средней ободочной артерии, приходится или дополнительно мобилизовать термальную часть подвздошной кишки, если дуга Риолана не развита и оставление питания за счет левой ободочной артерии опасно, или чаще всего при хорошей дуге Рио- лана возможно оставить слепую кишку питаться за счет подвздошно-ободочной артерии, а выкроить трансплантат из восходящей, поперечной и частично нисходящей кишки с питанием трансплантата за счет левой подвздошной артерии.
В связи с тем что невозможно менять методику операции уже после выделения трансплантата, следует перед окончательным выбором методики пережимать мягким зажимом сосуды, которые подлежат пересечению.
Толстая кишка реагирует на ишемию не столь бурной перистальтикой, как тонкая кишка. Самым достоверным признаком хорошего кровоснабжения является отчетливая пульсация концевых артерий у верхнего отдела трансплантата. Если такой пульсации нет, то зажимы на сосудах следует держать в течение 10- 15 минут и следить за состоянием трансплантата.
Если серозная оболочка приобретает матовый оттенок, кишка становится серо-бурой, дряблой при нормальном артериальном давлении у больного, то эту кишку нельзя использовать в качестве трансплантата. Иногда в отдаленной от питающего сосуда части кишки пульсация мелких сосудов может быть и не выражена, но сохранение цвета и тонуса кишки свидетельствует о сохранении питания трансплантата. Исчезновение пульсации иногда возникает из-за спазма сосудов, который проходит после согревания кишки салфеткой, смоченной теплым физиологическим раствором.
Появление цианотического оттенка кишки, расширение венозных сосудов, появление венозного кровотечения из мелких ветвей указывают на недостаточность кровоснабжения,
Э. Н. Ванцян и А. П. Крендаль применили термометрию трансплантата для оценки его жизнеспособности. При измерении электротермометром, по их данным, если температура дистального отдела мобилизованного сегмента
~ 0е
толстой кишки снижается на 3 по сравнению с температурой нормальной кишки, то это предупреждает об опасности омертвения трансплантата.
При пластике правой половины ободочной кишки с питанием трансплантата за счет средней ободочной артерии перевязывают и пересекают подвздошно-ободочную артерию на 2-3 см проксимальнее ветвления этого сосуда, а затем брыжейку рассекают до средней ободочной артерии.
Для питания трансплантата оставляют лишь краевой сосуд, являющийся анастомозом подвздошно-ободочной артерии со средней ободочной артерией. Подвздошную кишку пересекают у слепой кишки (обычно при помощи УКЛ-40), дистальный конец ее инвагинируют. Производят аппендэктомию.
Пересекают поперечную ободочную кишку на уровне ветвления средней ободочной артерии в бессосудистом участке с помощью аппарата УКЛ-60. На дистальный конец пересеченной поперечной ободочной кишки дополнительно накладывают кисетный шелковый шов или отдельные серозно-мышечные шелковые швы.
В малом сальнике делают отверстие и через него позади желудка проводят мобилизованную кишку так, чтобы не перекрутилась сосудистая ножка. Нижний конец трансплантата анастомозируют с передней стенкой желудка в антральном отделе. Для этого серозно-мышечные швы накладывают, отступя 2-3 см от края губы толстой кишки, и на желудок, а затем стенку желудка рассекают на длину просвета кишки, отступя на 2-3 см от линии швов. Накладывают непрерывный кетгутовый шов взахлестку через все слои кишки и желудок.
Иногда мы накладываем отдельные кетгу- товые швы с завязыванием узелков на слизистой оболочке. Окончательно формируют


- Схема выкраивания толстокишечного трансплантата по методике
переднюю губу анастомоза путем наложения серозно-мышечных швов, отступя 2-3 см от линии анастомоза.
Затем формируют межкишечное соустье между подвздошной кишкой и дистальным отделом толстого кишечника.
Montenegro, Cutait сообщили в 1952 г. об изоперистальтической пластике с включением в трансплантат поперечной ободочной кишки с небольшими участками восходящей и нисходящей кишок с питанием за счет левой ободочной артерии (рис. 251). Слепую кишку сшивают с нисходящей или сигмовидной кишкой анастомозом конец в конец. Montenegro и Cutait проводили кишку внутриплеврально на шею, где приводящий конец соединяли с оральным отделом пищевода, а отводящий в брюшной полости вшивали в стенку желудка, а при отсутствии его соединяли с тощей, двенадцатиперстной кишкой или отводящей петлей после резекции желудка.
Для тотальной эзофагопластики из правой половины толстой кишки мы чаще всего пользуемся следующей методикой, выполненной
А. А. Шалимовым в 1956 г.
Трансплантат выделяем из восходящей поперечной ободочной части нисходящей кишки. При этом необходимо, чтобы левая ободочная артерия была достаточно крупной, хорошо выражена риолановая дуга и имелся сосудистый анастомоз между средней и правой ободочными артериями (рис. 252).
Оставляем илео-цекальный угол для анастомоза нисходящей кишкой, в результате чего сохраняем функцию баугиниевой заслонки, так как, согласно исследованиям Е. А. Дыски- на (1957), удаление илео-цекального угла при его патологии вызывает у оперированных резкие нарушения функции желудочно-кишечного тракта, возникает значительное усиление моторной деятельности тонкой кишки.
Операцию начинаем с мобилизации илео-це- кального угла, вместе с восходящей, поперечной ободочной и частью нисходящей кишок. При выкраивании трансплантата толстую кишку пересекаем на границе слепой и восходящей с пересечением восходящей ветви a. ileocolica. Нисходящую кишку пересекаем тотчас же и ниже развилки ствола левой обо-

дочной артерии. При формировании трансплантата последовательно пересекаем восходящую ветвь подвздошно-ободочной артерии, правую и среднюю ободочные артерии и вены. Питание трансплантата осуществляется левой ободочной артерией, сохраняется и одноименная вена, полностью дуга Риолана, в то время как при использовании левой толстой кишки для эзофагопластики изоперистальтически в ряде случаев происходит разрыв дуги Рио- лана.
Непрерывность толстого кишечника восстанавливаем, накладывая анастомоз между слепой и нисходящей кишками конец в конец.
Для увеличения площади соприкасаемых поверхностей мы разработали и применили следующий вариант толстокишечного анастомоза конец в конец (рис. 253). Для этого подводим оба конца толстой кишки (обычно прошитые скобками УК.Л для лучшей асептики). В центре боковой поверхности подведенного орального конца кишки серо-серозные швы накладываем отступя 2-2,3 см от края, а дистального конца - 0,5 см от края. Дальнейшие серо-серозные швы на оральном конце накладываем так, чтобы они по бокам дошли до 0,5 см от края скрепочных швов. Затем скрепочные швы срезаем и делаем добавочный разрез орального конца кишки, подшитой на 2-2,3 см от края, на 1,8-2 см, не доходя 0,5-0,4 см до серо-серозных швов. Острые углы срезаем. На противоположной стороне дистального конца толстой кишки также делаем добавочный разрез кишки на 1,2-2 см.
Накладываем непрерывный кетгутовый шов взахлестку через все слои кишки. Накладываем серозно-мышечные швы на переднюю губу анастомоза. Линии стыковки швов укрепляем П-образными швами. Эти добавочные боковые разрезы обеих концов кишки при наложении швов дают расширение линии анастомоза как раз на такую величину, на которую дает сужение анастомоза при сшивании концов. Для лучшего функционирования трансплантат проводим позади желудка, через окно в малом сальнике и помещаем. в загрудинном тоннеле изоперистальтически (рис. 254). Дистальный конец его анастомо- зируем с передней стенкой тела желудка, следя за сосудистой ножкой трансплантата, находящейся позади желудка, чтобы не было натяжения и перегибов ее. Оральный конец трансплантата соединяем с пищеводом (или глоткой) или по типу Г-образного анастомоза (рис. 255), или конец в конец (рис. 256). В случаях недостаточного развития анастомозов между левой и средней ободочной артериями мобилизацию кишки выполняем по Lafargue с отрезком подвздошной кишки (см. рис. 256); в остальном пластика не отличается (рис. 257) от нашей методики.
Эзофагопластика правой половины толстой кишки в антиперистальтическом направлении выполняется относительно редко. Впервые о подобной операции упомянули Scandon и Staley (1958). В клинике ее успешно применили Jezioro (1961), Я- В. Волколаков (1962) (рис. 258).
Хотя расположенный антиперистальтически трансплантат уступает по своим функциональным качествам изоперистальтическому, тем не менее в связи с особенностями архитектоники сосудов толстой кишки иногда во время операции может возникнуть необходимость в применении антиперистальтически расположенного трансплантата.
Трансплантат из правой половины толстой кишки с антиперистальтическим расположением образовывается тогда, когда связи между правой ободочной и подвздошно-ободочной артериями выражены лучше, чем связи между правой и средней ободочными артериями, а использование левой половины также невозможно (сосудистая архитектоника и другие причины). Питающей ножкой такого трансплантата будет подвздошно-ободочная артерия. В трансплантат в таком случае входят слепая, восходящая и часть поперечной ободочной петель кишечника, При образовании трансплантата пересекают правую ободочную, а если не хватает его длины, то и среднюю ободочную артерии.
Тотальная эзофагопластика правой половины поперечной ободочной и восходящей кишками в изоперистальтическом направлении иногда может быть выполнена также в случаях, когда средняя ободочная артерия направлена к левой половине или хотя бы




- Толстокишечная загрудинная эзофагопластика. Окончательный вид операции.
И. П. Кралевец и др., 1969; Haupt, 1958; Grok, 1959; Storey, Boyer, 1960; binder. Hacker, 1962).
Левая половина толстого кишечника, по данным И. С. Мгалоблишвили (1961), А. Н. Ма- чабели (1962), П. И. Андросова (1964), В. И. Попова и В. Н. Филина (1965), Water- ston (1963), более жизнеспособна после мобилизации.
Впервые тотальную эзофагопластику за счет левой половины ободочной кишки в антипе- ристальтическом направлении, проведя кишку предгрудинно, выполнили в 1950 г. Orsoni и Toupet; питание трансплантата происходило за счет средней ободочной артерии (рис.260). В последующем эту операцию применяли В. И. Попов (1957), И. М. Мгалоблишвили (1960), Beck и Baronofsky (1960).
Эта методика стала основной методикой мобилизации из левой половины ободочной кишки с антиперистальтическим расположением трансплатата; так как левую половину толстой кишки удается чаще всего расположить только антиперистальтически.
Создание пищевода из левой половины толстой кишки с антиперистальтическим расположением трансплантата. Эта методика в основном применяется при недостаточных анастомозах между правой и средней ободочными артериями и недостаточно развитой левой ободочной артерией.
Мобилизацию кишечного трансплантата из левой половины толстой кишки начинают с выделения нисходящего отдела толстой кишки, производят отсечение большого сальника и пересечение желудочно-ободочной связки, а затем левую диафрагмально-ободочную и тол- стокишечно-селезеночные связки.
Измеряют расстояние от верхнего края брыжейки поперечной ободочной кишки до угла нижней челюсти. Если мобилизованная часть левой половины толстой кишки оказывается недостаточной длины, мобилизуют и верхнюю часть сигмовидной кишки.
Для выделения кишечного трансплантата рассекают брыжейку в бессосудистой части

ниже дуги Риолана, пересекают и перевязывают левую ободочную и одну или две сигмовидные артерии. Пересекают краевой сосуд в области сигмовидной кишки. На сигмовидную кишку на уровне намеченного пересечения накладывают два ряда скобок аппаратом УКЛ-60 и пересекают между ними.
Производят пересечение поперечной ободочной кишки на уровне ветвления средней ободочной артерии так, чтобы при расправлении дуги Риолана оральный конец трансплантата свободно подводился к желудку для анастомоза. Накладывают анастомоз конец в конец между отрезками толстой кишки и ушивают брыжейку толстой кишки. Трансплантат проводят позади желудка, оральный конец поперечной ободочной кишки анастомозируют с телом желудка, а нисходящий отдел толстой кишки в антиперистальтическом направлении проводят тем или иным способом и анастомо- зируют с пищеводом.
Однако антиперистальтическое расположение толстой кишки приводит к регургитации ее содержимого в ротовую полость, особенно при анастомозах с глоткой. При этом со временем хотя регургитация и уменьшается, но перистальтика в обратном направлении остается в течение длительного времени. Так, В. Ф. Жупан (1967) наблюдал ее даже через 8 лет после операции. Отрыжка тухлым и ре- гургитации, особенно мучительные у пожилых людей наблюдали и другие авторы (С. Т. Ярцев, 1961; И. С. Мгалоблишвили, 1961; И. М. Матяшин, 1962; П. И. Андросов, 1964; В. Г. Василенко, А. М. Белозерцев, 1966; М. Л. Филимонов, 1967).
Это побуждало многих хирургов искать пути к изоперистальтическому расположению трансплантата из левой половины ободочной кишки. Впервые пластику левой половиной трансплантата толстой кишки с изоперисталь- тическим расположением выполнил Christophe (1951) (рис. 261).
В СССР в 1960 г. на XXVII Всесоюзном съезде хирургов В. И. Попов высказал мысль о возможности применения левой ободочной кишки для изоперистальтической эзофагопластики. Christophe (1951), И. М. Матяшин (1962), П. И. Андросов (1964), А. М. Белозерцев (1967) стали применять выполнение эзо- фагопластики изоперистальтической левой половиной ободочной кишки (части поперечной ободочной, нисходящей и части сигмовидной кишок) за счет питания трансплантата левой ободочной артерии.
Создание пищевода из левой половины толстой кишки с изоперистальтическим расположением трансплантата. Эта методика применяется при условии хорошей риолановой дуги и развитой левой ободочной артерии. Одни хирурги (И. М. Матяшин и др.) применяют ее как основную методику, другие, в том числе мы, при отсутствии хороших анастомозов между правой и средней ободочной артерией.
После срединной лапаротомии приступают к мобилизации левой половины толстой кишки. Для этого петли тонких кишок с нисходящим отделом толстой кишки покрывают влажным полотенцем и смещают вправо. Производят тщательную ревизию аортальной и венозной систем левой половины толстой кишки, особенно дуги Риолана, так как это - единственный анастомоз между средней ободочной и левой ободочной артериями и в этом участке краевой сосуд не имеет коллатералей. Венозный отток от трансплантата также проходит по небольшим краевым венам и тромбоз их ведет к венозному застою, ухудшает кровообращение в трансплантате и может привести к его некрозу.
Мобилизация кишечного трансплантата из левой половины начинается с рассечения брюшины в области переходной складки вдоль наружного края нисходящего отдела толстой кишки от сигмовидной кишки до селезеночного угла. Нисходящий отдел толстой кишки отодвигают медиально, а забрюшинную клетчатку расслаивают тупым и острым путем до места отхождения основных сосудов кишки.
Отсекают большой сальник и пересекают желудочно-ободочную связку, после чего поперечную ободочную кишку и нисходящий отдел оператор оттягивает кнутри левой рукой и пересекает толстокишечно-селезеночную и тол- стокишечно-диафрагмальную связки, полностью мобилизуя селезеночный угол,
Осматриваются кровеносные сосуды в брыжейке в сильном проходящем свете или с помощью зеркал-трансиллюминаторов. Временно пережимают среднюю ободочную артерию или ее ветви мягким сосудистым зажимом. Если кровоснабжение надежно, то перевязывают и пересекают среднюю ободочную артерию или ее левую ветвь и рассекают брыжейку в бессосудистой части до левой ободочной артерии.
Пересекают поперечную кишку на необходимом для пластики пищевода уровне при помощи УКЛ-40. Конец кишки, который должен стать шейным отделом искусственного пищевода, ушивают кисетным швом и проводят через окно в малом сальнике позади желудка.
Пересекают кишку на уровне ветвления левой ободочной артерии, проксимальный конец ее проводят также в окно в малом сальнике и анастомозируют с передней стенкой желудка в артериальном отделе. Сшивают поперечную кишку с нисходящей или сигмовидной кишкой конец в конец. Вначале накладывают серозно-мышечные узловатые швы на задней стенке сшиваемых. Затем через все слои накладывают кетгутовый шов взахлест- ку, а переднюю стенку анастомоза снова укрепляют одиночными серозно-мышечными швами. Места стыковки швов укрепляют П-образными швами.
Для увеличения площади соприкасаемых поверхностей мы разработали и применили следующий вариант толстокишечного анастомоза конец в конец. Для этого подводят оба конца толстой кишки (обычно прошитые скобками УКЛ для лучшей асептики). В центре боковой поверхности подведенного орального конца кишки серо-серозные швы накладывают отступя 2-2,3 см от края, а дистального конца - 0,5 см от края. Дальнейшие серо-серозные швы на оральном конце накладывают так, чтобы они по бокам дошли до 0,5 см от края скрепочных швов. Затем скрепочные швы срезают и делают добавочный разрез орального конца кишки, подшитой на 2-2,3 см от края - на 1,8-2 см, не доходя 0,5-0,4 см до серо-серозных швов. Острые углы срезают. На противоположной стороне дистального конца толстой кишки так же делают добавочный разрез кишки на 1,8-2 см.
Накладывают непрерывный кетгутовый шов взахлестку через все слои кишки, а затем серозно-мышечные швы на переднюю губу анастомоза. Линии стыковки швов укрепляют П-образными швами. Эти добавочные боковые разрезы обеих концов кишки при наложении швов дают расширение линии анастомоза как раз на такую величину, на которую дает сужение анастомоза при сшивании концов.
Slawinski (1912) предложил оригинальную пластику пищевода участком подвздошной кишки с небольшим участком стенки слепой кишки, сохраняющей баугиниеву заслонку. Трансплантат питается за счет подвздошноободочных сосудов (рис. 262). При этом ободок стенки слепой кишки вшивают в желудок; баугиниева заслонка выполняет роль карди1 ального сфинктера, а приводящий конец трансплантата подвздошной кишки используется для соединения с пищеводом. В связи с тем что трансплантат питается за счет подвздошно-ободочной артерии, слепую кишку и часть восходящей иссекают.
В 1958 г. Jezioro предложил илео-цеко- пластику, при которой мобилизуется участок подвздошной кишки с илео-цекальным углом. Питание трансплантата осуществлялось за счет подвздошно-ободочной артерии (рис. 263). Слепую кишку при этом анастомозируют с желудком, где баугиниева заслонка выполняет роль кардиального сфинктера, а приводящий конец подвздошной кишки используется для соединения с пищеводом (см. схему).
Пластика правой половиной толстой кишки

- Схема операции Славинского.
- Илео-цекальная пластика (Lezioro, 1958; Dor, 1963)
- Поперечной кишкой в антиперистальтическом положении (Vuillet, 1911)
- Поперечной, нисходящей кишками в антиперисталь- тическом положении (Orsoni, Toupet, 1950)
- Поперечной, нисходящей и частью сигмовидной кишками в изоперистальтическом положении (Christophe, 1951; В. И. Попов, 1960; И. М. Матяшин, 1964)
- И. Козлов (1966) и др.
Анастомоз можно наложить сразу же во время пластики пищевода или этот этап операции осуществлять спустя определенный срок после перемещения трансплантата на шею.
Необходимым условием для одномоментного наложения соустья является достаточная длина трансплантата и его жизнеспособность.

263. Схема операции Ециоро.
Если возникает недостаточность швов анастомоза при одномоментной эзофагопластике, то возникает гнойный медиастинит или эмпиема плевры при загрудинной, задне-медиасти- нальной и внутриплевральной эзофагоплас- тике.
Формирование соустья на шее в один этап у детей связано с длительностью эндотрахе- ального наркоза и дополнительной операционной травмы трахеи извне при выделении шейного отдела пищевода, что может привести к отеку слизистой оболочки гортани и трахеи.
Наилучшие сроки для формирования анастомоза во второй этап - спустя 7-10 дней или 2-3 месяца. В этот период рубцовые сужения трансплантата с окружающими тканями или еще нерезко выражены, или претерпели обратное развитие, менее выражена пост- травматическая инфильтрация и кровоснабжение его компенсировано.
Мы предпочитаем накладывать соустье трансплантата с пищеводом в один этап, за исключением тех случаев, когда имеется явная недостаточность кровоснабжения трансплантата.
 Двухэтапная операция затруднена введением в послеоперационном периоде, так как
Двухэтапная операция затруднена введением в послеоперационном периоде, так как
эзофагостома часто сопровождается нагноением в окружающих тканях, помимо этого формирование анастомоза во второй этап чаще осложняется свищами вследствие недостаточности накладываемых швов в инфиль- тративной ткани, далее чаще возникают рубцовые стриктуры. Сокращение времени операции зависит от техники хирурга, проводящего все этапы эзофагопластики; целесообразно включить гастростому в анастомоз с дистальным концом трансплантата и, наконец, больному снова приходится производить операцию под наркозом, когда всего этого можно свободно избежать без вреда для больного.
Выбор типа анастомоза зависит от уровня наложения его на шее и от трансплантата - тонкой, толстой кишки, желудка или его трубчатого лоскута.
Анастомоз конец пищевода в конец или бок трансплантата. Такой анастомоз чаще всего накладывают после резекции пищевода по То- реку с выведением на шею трансплантата или при низкой рубцовой стриктуре пищевода, когда внутригрудная пластина противопоказана при условии сохранения хотя бы небольшой проходимости пищевода. В таких случаях пересекают пищевод в шейном отделе, что не позволяет попадать пище в супрастенотиче- ский отдел пищевода. Но такая методика требует ушивания дистальной культи пищевода и при дальнейшем рубцевании, когда может образоваться полная непроходимость его на уровне рубцовой стриктуры, создает угрозу образования замкнутой полости из оставшейся части пищевода.
Если такая полость не опорожняется в желудок, то находящаяся там слизь, а затем и гной могут прорываться в средостение, плевральную полость или бронх (А. Г. Савиных,
А. Г. Соловьев, С. С. Юдин и др.). К счастью, такие осложнения встречаются редко. Кроме того, во избежание образования слепых мешков при низко расположенных рубцовых стриктурах обычно применяют пластику с образованием внутриплеврального соустья непосредственно выше стриктуры (рис. 264); противопоказания к внутригрудным пластикам редки.
Доступ к шейному отделу пищевода может быть осуществлен как слева, так и справа. Но в основном хирурги пользуются левосторонним доступом, так как в этом отделе пищевод смещен влево и лучше доступен.
Производится разрез кожи и подкожной мышцы по внутренному краю грудино-клю-
чично-сосцевидной мышцы. Рассекают фасцию и кивательную" мышцу вытягивают тупыми крючками кнаружи, Пересекают лопаточноподъязычную и далее грудинно-щитовидную мышцы.
Перевязывают и пересекают между двумя лигатурами переднюю лицевую вену, верхнюю и нижнюю щитовидные артерии. Сосудистонервный пучок отводят тупым крючком кнаружи. Значительно облегчает выделение пищевода введение в его супрастенотический отдел толстого резинового зонда. При этом все манипуляции следует проводить осторожно, так как между пищеводом и трахеей лежит основной ствол подвздошного нерва, который можно ранить. Оставляя возвратный нерв сверху трахеи, по рыхлой клетчатке освобождается пищевод от трахеи. Под мобилизованный пищевод с помощью зажима Федорова подводят резиновый катетер-держалку и освобождают дальше пищевод тупо и остро от окружающей его рыхлой клетчатки.
В нижнем отделе пищевода рассекают вокруг мышечную оболочку до слизистой оболочки, при этом выделяют добавочно слизистую оболочку книзу. У нижней части слизистую оболочку прошивают и перевязывают. Выше слизистую оболочку берут на зажим и между лигатурой и зажимом пересекают. На мышечную оболочку накладывают ряд узловых шелковых швов и культя пищевода погружается в средостение.
Существуют и другие методы обработки дистального конца пищевода.
Для наложения первого ряда на слизистую оболочку дистальной культи пищевода (Э. Н. Ванцян, Р. А. Тощаков, 1971) используют аппараты УКЛ и НЖКА, а затем накладывают узловые шелковые швы на мышечную оболочку пищевода.
В. И. Попов и В. И. Филин (1965) прошивают выделенный шейный отдел пищевода как можно ниже шелковой ниткой, которую завязывают на две стороны. На 0,5 см выше места перевязки надсекают мышечный слой пищевода до слизистой оболочки, последнюю выделяют, прошивают отдельно шелковой ниткой и перевязывают на обе стороны. Пищевод пересекают выше этого места.
И. И. Греков (1922), А, Ю, Озолинг (1925) аборальный конец пищевода вшивали в кожу, рассчитывая на то, что пищевод постепенно облитерируется и свищ закроется. И. М. Стель- машонок (1970) аборальный конец пищевода не ушивает, а предпочитает дренирование в течение нескольких дней резиновой трубкой с введением через нее антибиотиков.
Анастомоз конец в конец мы накладываем следующим образом.
Культю трансплантата подводят к пищеводу, где и накладывают первый ряд серозномышечных узловатых шелковых швов, отступя 0,8 см от танталовых скобок на кишке и 2-2,5 см на пищеводе от конца пересечения. Под зажимом рассекают заднюю стенку пищевода и срезают танталовые швы на культе трансплантата, заднюю стенку пищевода добавочно рассекают на 1,5-2 см продольно. На заднюю губу анастомоза кладут узловатые шелковые швы через все слои стенок пищевода и желудок. Отсекают переднюю стенку пищевода с зажимом Федорова и сшивают переднюю губу анастомоза через все слои узловатыми шелковыми швами с завязыванием узелков внутрь просвета анастомоза. На переднюю губу накладывают второй ряд швов - серозно-мышечные узловатые шелковые, а в слабых местах П-образные. Добавочное рассечение пищевода дает удлинение линии анастомоза и является профилактикой в дальнейшем сужении анастомоза (рис. 256).
Излишние края толстой кишки с наложенными скрепочными швами ушиваются серо-серозными швами. Таким образом, анастомоз получается по типу инвагинационного.
Анастомоз бок в бок должен быть широким, так как узкие анастомозы подвергаются рубцовому сужению. Этому способствует длительный застой пищи в слепом мешке пищевода и связанный с этим хронический эзофагит.
Мы пользуемся следующей методикой. При локализации рубцовой стриктуры на уровне C7D2 между шейным отделом пищевода и трансплантатом накладываем Г-образный анастомоз, предложенный А. А. Шалимовым в 1967 г. К пищеводу серозно-мышечными швами подшивают кишку косо снизу вверх и слева направо на всем протяжении по передней
его поверхности (5-6 см), затем рассекают пищевод, отступя 1 см от серозных швов. Далее разрез продлевают вверх и уже влево на 1,5-2 см. Рассекают кишку, отступя 0,5 см от серо-серозных ш