Buněčná membrána. Propustnost membrán pro různé látky Které ionty zajišťují propustnost buněčných membrán
Membránové metody čištění jsou založeny na rozdílné propustnosti membrán pro složky čištěné plynné směsi.[...]
Selektivní propustnost membrán během procesu ultrafiltrace je vysvětlena čistě sítovým separačním mechanismem - částice nečistot mající větší velikost, než je velikost pórů membrány, membránou neprocházejí, pouze se přes ni filtruje voda.[...]
Selektivita a propustnost membrán musí být zvážena ve vztahu k nákladům na výrobu vzduchu obohaceného kyslíkem. Náklady na separaci vzduchu závisí na propustnosti, selektivitě, geometrických parametrech membrány, výkonu modulu, nákladech na energii a dalších faktorech. Náklady na vzduch obohacený kyslíkem se posuzují ve vztahu k ekvivalentnímu čistému kyslíku, definovanému jako množství čistého kyslíku potřebného ke smísení se vzduchem (21 % kyslíku), aby se vytvořilo stejné množství a procento kyslíku jako při procesu separace plynů v otázka.[...]
Ultrafiltrace je membránový proces pro separaci roztoků, jejichž osmotický tlak je nízký. Tato metoda se používá pro separaci látek s relativně vysokou molekulovou hmotností, suspendovaných částic a koloidů. Ultrafiltrace je ve srovnání s reverzní osmózou více produktivní proces, protože vysoké propustnosti membrány je dosaženo při tlaku 0,2-1 MPa.[...]
Praní pevného odpadu 434, 425 Propustnost membrány 273 Pasírování 197 slov [...]
Ionty vápníku mají velký vliv na membránové struktury. Potřeba Ca2+ iontů pro stabilizaci membrán byla zdůrazněna již poměrně dávno. Bylo prokázáno, že pro vytvoření povrchové membrány na endoplazmatické kapce izolované z internodálních buněk charopytových řas je nezbytná přítomnost Ca2+ iontů v okolním roztoku. Přítomnost Ca2+ v koncentraci 10 4 M přispěla k vytvoření povrchové membrány na kapce, i když nebyla dostatečně pevná; odolnější membrána se vytvořila při koncentraci 10"3 M a zejména 102 M. Při odstranění vápenatých iontů (například při ošetření cheláty nebo při nepřítomnosti Ca2+ v médiu) je zaznamenán sliz kořenových vlásků , a zvyšuje se i propustnost membrán pro další látky.Ionty Ca2+ se mění a elektrické vlastnosti umělých i přírodních membrán snižují hustotu náboje na povrchu membrány.Nedostatek Ca vede ke zvýšené vakuolizaci, změnám chromozomů, prasknutí membrán ER a další intracelulární kompartmenty.[...]
Se zvyšující se koncentrací separovaného roztoku se propustnost membrán snižuje a se zvyšujícím se tlakem se zvyšuje. Po procesu čištění se získá filtrát ochuzený o 90-99,5 °/o původních sloučenin a koncentrát se posílá k dalšímu zpracování.[...]
Reakce na acetylcholin a biogenní aminy spočívá ve změně permeability membrán pro ionty a/nebo v indukci syntézy sekundárních poslů. Přítomnost cAMP, cGMP, Ca2+ a také enzymů syntézy a katabolismu v rostlinné buňce a jejích organelách potvrzuje možnost lokálního zprostředkování.[...]
Pod vlivem mikrovlnného EMR (2,45 GHz) byl tedy zjištěn nárůst kationtové permeability membrán erytrocytů při pokojové teplotě, zatímco při absenci mikrovlnného EMR byl podobný efekt pozorován pouze při teplotě 37 °C. [...]
Skupiny metabolitů nejsou rovnoměrně distribuovány v celé buňce, ale jsou odděleny membránami a lokalizovány v samostatných kompartmentech (komůrky, kompartmenty). Komponenty metabolických fondů buňky jsou propojeny transportními toky. V souladu se selektivní permeabilitou membrán dochází k prostorové redistribuci meziproduktů a metabolických produktů. Například v buňce je zásoba ATP udržována díky „horizontálním“ spojením procesů fotosyntetické a oxidativní syntézy fosforu.[...]
Koncentrace roztoku. Se zvyšující se koncentrací separovaného roztoku klesá permeabilita membrán v důsledku zvýšení osmotického tlaku rozpouštědla a vlivem koncentrační polarizace. Když je hodnota Reynoldsova kritéria 2000-3000, polarizace koncentrace prakticky chybí, ale turbulizace roztoku je spojena s jeho vícenásobnou recirkulací, tj. spotřebou energie, a vede k hromadění suspendovaných částic v roztoku a vzniku biologických znečištění [...]
Snížení teploty vody vedoucí k ochlazení ryb vede také ke zvýšení propustnosti membrán, které ztrácejí schopnost udržovat iontové gradienty. V tomto případě je narušena konjugace enzymatických reakcí, přestávají fungovat iontové pumpy, je narušena činnost centrálního a periferního nervového systému a inhibována činnost kardiorespiračního aparátu, což může v konečném důsledku vést k rozvoji hypoxie. Při přehřátí nebo ochlazení ryb v důsledku prudké změny teploty v omezeném čase má určitá role osmotický stres v důsledku narušení schopnosti těla udržovat určitou koncentraci iontů a bílkovin v krvi. Například pokles teploty z 25 na 11 °C způsobí, že tilapie chovaná ve sladké vodě se rozvine kóma, doprovázená poklesem koncentrace iontů sodíku a chloru a celkové bílkoviny v krvi. Podle autorů k úhynu ryb dochází v důsledku rozvoje osmoregulačního kolapsu a potlačení funkce ledvin. Nepřímým potvrzením tohoto předpokladu může být prevence teplotního kómatu u ryb chovaných ve zředěném stavu mořská voda, což je v souladu s dřívějšími pozorováními zvýšené tepelné odolnosti ryb v důsledku přidání iontů sodíku, vápníku a hořčíku do vody. Je však třeba mít na paměti, že důvody úhynu ryb při zvýšených nebo nízkých teplotách jsou různé a závisí na délce a intenzitě teplotní expozice.[...]
hodnota PH. Změna počáteční hodnoty pH obvykle vede ke snížení permeability membrány. Vliv pH na membránovou selektivitu je malý. Těkavé kyseliny jsou špatně zadržovány membránami, takže předběžná neutralizace těkavých kyselin zvyšuje selektivitu separačního procesu.[...]
Při vysokých koncentracích solí v tříkomorovém elektrodialyzátoru s inertními membránami nepřesahuje maximální výstupní proud 20 %.[...]
Bylo dosaženo pozitivních výsledků čištění odpadní voda z OP-7 reverzní osmózou při tlaku 5 MPa. Propustnost membrán byla 5-20,8 l/(m2-h) při koncentraci OP-7 ve filtrátu 1-18 mg/l.[...]
Surfaktanty (alkylsulfáty) stimulují růst bakterií v největší míře. Povrchově aktivní látky mohou navíc změnou propustnosti membrán živých buněk (S. S. Stroev, 1965 aj.) přispět k lepší absorpci živin obsažených ve vodě mikroby.[...]
Povaha rozpuštěné látky má určitý vliv na selektivitu a v menší míře na propustnost membrán. Tento efekt spočívá v tom, že anorganické látky jsou membránami zadržovány lépe než organické látky se stejnou molekulovou hmotností; mezi příbuznými sloučeninami, např. homology, se lépe udrží látky s vyšší molekulovou hmotností; látky, které tvoří vazby s membránou, např. vodík, jsou membránou zadržovány tím lépe, čím je tato vazba méně pevná; Čím větší je molekulová hmotnost rozpuštěné látky, tím větší je selektivita retence vysokomolekulárních sloučenin ultrafiltrací.
Membrány vyrobené z acetátu celulózy mohou pracovat v rozmezí pH 4,5-7 a membrány vyrobené z chemicky odolných polymerů - při pH 1-14. Propustnost membrán je zvolena tak, aby umožňovala průchod vody, rozpustných solí a zadržování olejů. Velikost pórů v membránách je obvykle v rozmezí 2,5-10 nm. Instalace je vybavena pomocnými potrubími pro promývání membrán filtrátem nebo demineralizovanou vodou, vybavenými kontrolními a měřicími přístroji a automatickými zařízeními.[...]
Při významném snížení rozdílu intracelulárního potenciálu na určitou prahovou úroveň je pozorována prudká změna permeability membrány a obrácení toků iontů. Do ní vstupují ionty vápníku z vnějšího prostředí obklopujícího buňku a ionty chloru a draselné ionty odcházejí z buňky do promývacího roztoku.[...]
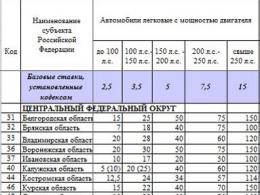
Tolerance je spojena s vnitřními faktory a zahrnuje takové metabolické procesy, jako je selektivní absorpce iontů, snížená propustnost membrán, imobilizace iontů v určitých částech rostlin, odstranění iontů z metabolických procesů vytvořením rezervy v nerozpustných formách v různých orgánech, adaptace k náhradě fyziologického prvku toxickým v enzymu, odstraňování iontů z rostlin vyplavováním přes listy, sekrece šťávy, opadávání listů, vylučování kořeny. Tolerantní rostliny mohou být stimulovány zvýšenými koncentracemi kovů, což naznačuje jejich fyziologickou potřebu přebytku. Některé druhy rostlin jsou schopny akumulovat značné množství těžkých kovů bez viditelných známek inhibice. Jiné rostliny tuto schopnost nemají (viz tabulka[...]
Tlak je jedním z hlavních faktorů určujících výkon zařízení na reverzní osmózu. Výkon membrány se zvyšuje se zvyšujícím se přetlakem. Od určitého tlaku však propustnost membrán klesá v důsledku zhutňování polymerního materiálu membrány.[...]
Bylo také zjištěno, že nízká ([...]
Protože hemicelulózové polysacharidy mají číselný průměr molekulové hmotnosti ne více než 30 000, je použití konvenční osmometrie obtížné kvůli propustnosti membrán pro frakce s nízkou molekulovou hmotností. Metoda parní osmometrie navržená Hillem má oproti jiným metodám řadu výhod. Tato metoda je založena na měření rozdílu tlaku par mezi roztokem a rozpouštědlem a je následující. Kapka roztoku a kapka rozpouštědla se umístí na dva termočlánkové spoje a udržují se v atmosféře nasycené čistými párami rozpouštědla. Kvůli nízký krevní tlak pára roztoku, část páry bude kondenzovat na kapce roztoku, čímž se zvýší teplota kapky a termočlánku. Výsledná elektromotorická síla je měřena galvanometrem. Horní hranice naměřené hodnoty molekulové hmotnosti je asi 20 000, přesnost měření je 1 %. [...]
Konečně membrány endoplazmatického retikula jsou povrchy, po kterých se šíří bioproudy, což jsou signály, které mění selektivní permeabilitu membrán a tím i aktivitu enzymů. Díky tomu se některé chemické reakce uvedou do pohybu, jiné se brzdí – metabolismus podléhá regulaci a probíhá koordinovaně. [...]
Plazmalema reguluje vstup látek do buňky a z buňky a zajišťuje selektivní průnik látek dovnitř a ven z buňky. Rychlost průniku přes membránu různých látek je různá. Dobře přes něj proniká voda a plynné látky. Snadno pronikají i látky rozpustné v tucích, pravděpodobně díky tomu, že má lipidovou vrstvu. Předpokládá se, že lipidová vrstva membrány je prostoupena póry. To umožňuje látkám nerozpustným v tucích pronikat membránou. Póry nesou elektrický náboj, takže průnik iontů jimi není zcela volný. Za určitých podmínek se mění náboj pórů a tím se reguluje propustnost membrán pro ionty. Membrána však není stejně propustná pro různé ionty se stejným nábojem a pro různé nenabité molekuly podobné velikosti. Tím se odhaluje nejdůležitější vlastnost membrány - selektivita její permeability: pro některé molekuly a ionty je propustná lépe, pro jiné hůř.[...]
V současnosti je obecně přijímán mechanismus působení mediátorů v živočišných a rostlinných buňkách, který je založen na regulaci iontových toků. Změny membránových potenciálů jsou způsobeny posuny iontové permeability membrány prostřednictvím otevírání nebo uzavírání iontových kanálů. S tímto jevem jsou spojeny mechanismy výskytu a šíření PD v živočišných a rostlinných buňkách. V živočišných buňkách jsou to N7K+ kanály řízené acetylcholinem a Ca2+ kanály, často závislé na biogenních aminech. V rostlinných buňkách je výskyt a šíření PD spojeno s vápníkovými, draselnými a chloridovými kanály.[...]
S větší reprodukovatelností a stabilitou lze dosáhnout stabilního proudění plynů a par metodami založenými na difúzi plynů nebo kapalných par kapilárou (obr. 10) nebo propustnou membránou (obr. 11) do proudu ředicího plynu. Při takových metodách je pozorována rovnováha mezi plynnou fází a adsorpčními plochami zařízení, což zajišťuje stabilitu mikrotoku.[...]
Zvýšení teploty vede ke snížení viskozity a hustoty roztoku a zároveň ke zvýšení jeho osmotického tlaku. Snížení viskozity a hustoty roztoku zvyšuje propustnost membrán a zvýšení osmotického tlaku snižuje hnací sílu procesu a snižuje propustnost.[...]
REP existuje v každém živém systému a bylo by překvapivé, kdyby neexistoval. To by znamenalo absolutní rovnost koncentrací elektrolytů ve všech buňkách, orgánech, vnějších roztocích nebo úplnou shodu hodnot membránové permeability se všemi kationty a anionty.[...]
V experimentu 6, podobně jako v experimentu 1, bylo stanoveno množství uvolněného draslíku a organické hmoty rozpustné ve vodě při různých koncentracích atrazinu. Soudě podle získaných výsledků lze říci, že atrazin nezvyšuje propustnost membrán pro nízkomolekulární organická hmota a zvyšuje se u draslíku. Tento účinek byl úměrný koncentraci atrazinu.[...]
Při vyšetřování jedinců, kteří byli při své práci vystaveni nízkoúrovňovému záření (například radiologové a technici pracující s rentgenovým zářením, jehož dávky byly měřeny jednotlivými dozimetry) metodou stopovacího atomu, byly provedeny krevní testy ke zjištění propustnost membrán červených krvinek průchodem monovalentních kationtů. Bylo zjištěno, že propustnost membrán červených krvinek u jedinců vystavených záření byla výrazně vyšší než u těch, kteří nebyli vystaveni. Kromě toho graf závislosti umožnil stanovit rychlý nárůst permeability při nízkém ozáření; při vysokých dávkách se křivka stává plochou, podobně jako Stokkeho pozorování ve studiích na zvířatech (viz obr. X1U-3). Tyto údaje jsou v souladu s výsledky získanými Petkau.[...]
Při odsolování mineralizovaných odpadních vod hyperfiltrací přes polopropustné membrány je nutné stanovit hlavní parametry - koncentraci rozpuštěných látek v koncentrátu a filtrátu na jednotku šířky membrány pro danou délku, separační schopnost, koeficient propustnosti membrány, tlak, průtoky zdrojové vody, filtrátu a koncentrátu.[ .. .]
Možnost takového přizpůsobení je dána závislostí termodynamických, chemických a kinetických konstant na teplotě. Tato závislost obecně určuje směr a rychlost chemických reakcí, konformační přechody biologických makromolekul, fázové přechody lipidů, změny permeability membrán a další procesy, jejichž fungování zajišťuje životní činnost organismů při zvýšených teplotách.[. ..]
To vše jsou jen první kroky v oblasti využití magnetizované vody v medicíně. Dosavadní informace však naznačují perspektivu využití magnetizace vodních systémů v této oblasti. Řada lékařských projevů možná (hypoteticky) souvisí s tím, že magnetizace vodných systémů zvyšuje propustnost membrán. [...]
Bylo zjištěno, že průmyslově vyráběné polymerní filmy pro ultrafiltraci, iontovou výměnu, jakož i membrány vyrobené z kolodia, želatiny, celulózy a dalších materiálů mají dobrou selektivitu, ale nízkou propustnost (0,4 l/m h při tlaku 40 hodin). Membrány připravené podle speciální receptury ze směsi acetátu celulózy, acetonu, vody, chloristanu hořečnatého a kyseliny chlorovodíkové (22,2, 66,7, 10,0, 1,1 a 0,1 hmotnostních procent) umožňují odsolování vody od 5,25 do 0,05 % NaCl a mají propustnost 8,5-18,7 l!m2 ■ h při pracovním tlaku 100-140 am, jejich životnost je minimálně 6 měsíců. Elektronové mikroskopické studie těchto membrán, protože podle předběžných výpočtů 1192] se reverzní osmóza může stát konkurenceschopnou jiným metodám odsolování vody, když se propustnost membrány zvýší na 5 m31 mg za den.[...]
Klidový potenciál buněčné stěny. Buněčná stěna (obal) má negativní povrchový náboj. Přítomnost tohoto náboje dává buněčné stěně odlišné vlastnosti výměny kationtů. Buněčná stěna se vyznačuje převládající selektivitou k iontům Ca2+, což hraje důležitou roli v regulaci permeability membrány s ohledem na ionty K a Na+.[...]
Zaznamenané účinky tedy naznačují, že kultivační kapalina mikromycety Fusarium oxysporum obsahuje kromě kyseliny fusarové také další složky s vysokou biologickou aktivitou. Stupeň patogenity různých izolátů fytopatogenních hub lze posoudit stanovením změn v propustnosti membrán rostlinných buněk pro amoniak.[...]
V důsledku toho se snižuje nebo zastavuje nová tvorba ATP, což vede k potlačení procesů, které jsou závislé na energii dýchání. Narušena je i struktura a selektivní propustnost membrán, jejichž udržení vyžaduje výdej dýchací energie. Tyto změny vedou ke snížení schopnosti buněk absorbovat a zadržovat vodu.[...]
Na druhé straně stabilizace prostorové struktury proteinu a dalších biopolymerů probíhá do značné míry díky interakci: biopolymer - voda. Za základ fungování živých systémů je považován komplex voda-protein-nukleová kyselina, protože pouze v přítomnosti těchto tří složek je možné normální fungování membrán. Selektivní propustnost membrán závisí na stavu vody. Extrapolací shlukového modelu vody na biologické systémy lze ukázat, že když je shluk v určitých oblastech membrány zničen, otevírá se cesta pro preferenční transport. Voda bez struktury například zabraňuje chování protonů v blízkosti membrány, zatímco protony se rychle šíří po strukturované struktuře.[...]
Je popsáno schéma kontinuální analýzy plynů pomocí iontově selektivní elektrody, kterou lze použít pro stanovení obsahu H3, HCl a HP v plynech. V přehledu práce US NBS je kromě jiných metod certifikace referenčních plynů (směsí) uveden i způsob certifikace pomocí iontově selektivních elektrod pro plyny NSI a NR. Ze všech provedení iontově selektivních elektrod se obvykle používá: iontově selektivní membrána odděluje dva roztoky - vnitřní a vnější (testováno). Pro elektrický kontakt je do vnitřního roztoku umístěna pomocná elektroda, vratná na ionty vnitřního roztoku, jejíž aktivita je konstantní, v důsledku čehož je konstantní i potenciál. Na vnitřním a vnějším povrchu membrány vzniká potenciální rozdíl v závislosti na rozdílu aktivity iontů ve vnějších a vnitřních roztocích. V práci je uvedena teorie výskytu membránového potenciálu. V zásadě se vznik potenciálu vysvětluje permeabilitou membrán buď pouze pro kationty (kationtově selektivní), nebo pouze pro anionty (aniontově selektivní).
· 4. 1. 2012
Mnoho článků o vodě zmiňuje negativní hodnoty ORP vnitřních tělesných tekutin a energie buněčných membrán (vitální energie těla).
Pokusme se přijít na to, o čem mluvíme, a pochopit význam těchto výroků z populárně vědeckého hlediska.
Mnoho pojmů a popisů bude uvedeno ve zkrácené formě a úplnější informace lze získat z Wikipedie nebo z odkazů uvedených na konci článku.
(Nebo cytolemma, nebo plasmalemma, nebo plazmatická membrána) odděluje obsah jakékoli buňky od vnějšího prostředí a zajišťuje její integritu; regulují výměnu mezi buňkou a vnějším prostředím.
Buněčná membrána je natolik selektivní, že bez jejího svolení nemůže do buňky ani náhodou proniknout jediná látka z vnějšího prostředí. V buňce není jediná zbytečná, nepotřebná molekula. Výstupy z cely jsou také pečlivě kontrolovány. Fungování buněčné membrány je zásadní a nedovolí ani sebemenší chybu. Zavedení škodlivé chemické látky do buňky, přísun nebo uvolnění látek v nadměrném množství nebo selhání vylučování odpadu má za následek buněčnou smrt.

Volné radikály útočí
Bariéra - zajišťuje regulovaný, selektivní, pasivní a aktivní metabolismus s okolím. Selektivní permeabilita znamená, že propustnost membrány pro různé atomy nebo molekuly závisí na jejich velikosti, elektrickém náboji a chemické vlastnosti. Selektivní permeabilita zajišťuje oddělení buňky a buněčných kompartmentů od prostředí a zásobení potřebnými látkami.
Selektivní permeabilita membrány během pasivního transportu je způsobena speciálními kanály - integrálními proteiny. Pronikají membránou přímo skrz a tvoří jakýsi průchod.
Pro prvky K, Na A Cl mají své vlastní kanály. Vzhledem ke koncentračnímu gradientu se molekuly těchto prvků pohybují dovnitř a ven z buňky. Při podráždění se kanály sodíkových iontů otevřou a dojde k náhlému přílivu sodíkových iontů do buňky. V tomto případě dochází k nerovnováze membránového potenciálu. Poté se membránový potenciál obnoví. Draslíkové kanály jsou vždy otevřené, což umožňuje iontům draslíku pomalu vstupovat do buňky.
Transport - transport látek do a z buňky probíhá přes membránu. Transport přes membrány zajišťuje: dodání živin, odstranění konečných produktů metabolismu, sekreci různých látek, vytvoření iontových gradientů, udržení optimální pH a koncentrace iontů, které jsou potřebné pro fungování buněčných enzymů.
Existují čtyři hlavní mechanismy pro vstup látek do buňky nebo jejich odstranění z buňky ven: difúze, osmóza, aktivní transport a exo- nebo endocytóza. První dva procesy jsou pasivní povahy, to znamená, že nevyžadují energii; poslední dva jsou aktivní procesy spojené se spotřebou energie.
Při pasivním transportu látky procházejí lipidovou dvojvrstvou, aniž by vynakládaly energii podél koncentračního gradientu difúzí.
Aktivní transport vyžaduje energii, protože probíhá proti koncentračnímu gradientu. Na membráně jsou speciální pumpové proteiny, včetně AT fáze, která aktivně pumpuje draselné ionty do buňky ( K+) a odčerpejte z něj ionty sodíku ( Na+).
Implementace tvorby a vedení biopotenciálů. Pomocí membrány je v buňce udržována konstantní koncentrace iontů: koncentrace iontů K+ uvnitř buňky je mnohem vyšší než venku a koncentrace Na+ výrazně nižší, což je velmi důležité, protože to zajišťuje udržení rozdílu potenciálů na membráně a generování nervového impulsu.
Označení buněk- na membráně jsou antigeny, které fungují jako markery - "štítky", které umožňují identifikaci buňky. Jedná se o glykoproteiny (tj. proteiny s navázanými rozvětvenými oligosacharidovými postranními řetězci), které hrají roli „antén“. Kvůli nesčetným konfiguracím postranních řetězců je možné vytvořit specifický marker pro každý typ buňky. Pomocí markerů mohou buňky rozpoznat jiné buňky a jednat ve shodě s nimi, například při tvorbě orgánů a tkání. To také umožňuje imunitnímu systému rozpoznat cizí antigeny.
 Akční potenciál
Akční potenciál
Akční potenciál- excitační vlna pohybující se po membráně živé buňky při přenosu nervového signálu.
V podstatě se jedná o elektrický výboj - rychlou krátkodobou změnu potenciálu v malé oblasti membrány excitabilní buňky (neuronu, svalového vlákna nebo žlázové buňky), v důsledku čehož vnější povrch této Oblast se nabije záporně ve vztahu k sousedním oblastem membrány, zatímco její vnitřní povrch se nabije kladně ve vztahu k sousedním oblastem membrány.
Akční potenciál je fyzický základ nervový nebo svalový impuls, který hraje signalizační (regulační) roli.
Akční potenciály se mohou lišit ve svých parametrech v závislosti na typu buňky a dokonce i na různé oblasti membrány téže buňky. Většina typický příklad rozdíly: akční potenciál srdečního svalu a akční potenciál většiny neuronů.
Nicméně v jádru jakékoli akční potenciál leží následující jevy:
- Membrána živé buňky je polarizovaná- jeho vnitřní povrch je ve vztahu k vnějšímu povrchu záporně nabitý, protože v roztoku v blízkosti jeho vnějšího povrchu je větší počet kladně nabitých částic (kationtů) a v blízkosti vnitřního povrchu je větší počet záporně nabitých částic nabité částice (anionty).
- Membrána má selektivní propustnost- jeho propustnost pro různé částice (atomy nebo molekuly) závisí na jejich velikosti, elektrickém náboji a chemických vlastnostech.
- Membrána excitovatelné buňky je schopna rychle měnit svou propustnost pro určitý typ kationtů, způsobující přechod kladného náboje z vnějšku dovnitř.
Polarizace membrány živé buňky je způsobena rozdílem v iontovém složení na její vnitřní a vnější straně.
 Když je buňka v klidném (neexcitovaném) stavu, ionty na opačných stranách membrány vytvářejí relativně stabilní potenciálový rozdíl, nazývaný klidový potenciál. Pokud vložíte elektrodu do živé buňky a změříte klidový membránový potenciál, bude mít zápornou hodnotu (asi -70..-90 mV). To je vysvětleno skutečností, že celkový náboj na vnitřní straně membrány je výrazně menší než na vnější straně, ačkoli obě strany obsahují kationty a anionty.
Když je buňka v klidném (neexcitovaném) stavu, ionty na opačných stranách membrány vytvářejí relativně stabilní potenciálový rozdíl, nazývaný klidový potenciál. Pokud vložíte elektrodu do živé buňky a změříte klidový membránový potenciál, bude mít zápornou hodnotu (asi -70..-90 mV). To je vysvětleno skutečností, že celkový náboj na vnitřní straně membrány je výrazně menší než na vnější straně, ačkoli obě strany obsahují kationty a anionty.
Venku je řádově více iontů sodíku, vápníku a chloru, uvnitř jsou ionty draslíku a záporně nabité molekuly bílkovin, aminokyseliny, organické kyseliny, fosfáty, sírany.
Musíme pochopit, že mluvíme konkrétně o náboji povrchu membrány – obecně je prostředí uvnitř i vně buňky neutrálně nabité.
Aktivní vlastnosti membrány, které zajišťují vznik akčního potenciálu, jsou založeny především na chování napěťově řízeného sodíku ( Na+) a draslík ( K+) kanály. Počáteční fáze AP je tvořena příchozím sodíkovým proudem, později se otevírají draslíkové kanály a odcházejí K+- proud vrací membránový potenciál na původní úroveň. Počáteční koncentrace iontů je poté obnovena sodíkovo-draslíkovou pumpou.
Jak PD postupuje, kanály se pohybují ze stavu do stavu: y Na+ existují tři hlavní stavové kanály - uzavřený, otevřený a neaktivovaný (ve skutečnosti je věc složitější, ale tyto tři k popisu stačí), K+ Existují dva kanály - uzavřený a otevřený.
závěry
1. ORP intracelulární tekutiny má skutečně negativní náboj
2. Energie buněčných membrán souvisí s rychlostí přenosu nervových signálů a myšlenka „dobíjení“ intracelulární tekutiny vodou s ještě zápornějším ORP mi připadá pochybná. Pokud však předpokládáme, že na cestě do buňky voda výrazně ztratí svůj redoxní potenciál, pak má toto tvrzení velmi praktický význam.
3. Nesprávná funkce membrány v důsledku nepříznivého prostředí vede k buněčné smrti
Bimolekulární vrstva fosfolipidů tvoří základ každé buněčné membrány. Jeho kontinuita určuje bariérové a mechanické vlastnosti buňky. Během života může být kontinuita dvojvrstvy narušena tvorbou strukturálních defektů, jako jsou například hydrofilní póry. Je zcela přirozené to očekávat. V tomto případě se mění všechny funkce buněčné membrány, včetně permeability a stability.
Mezi tekuté krystaly patří fosfolipidy, které tvoří základ buněčných membrán. Jako v každém skutečném krystalu může vrstva fosfolipidů obsahovat defekty, na jejichž místě se vyvíjejí hlavní děje strukturálních přeskupení. Typy defektů jsou různé, ale nejpřirozenějším defektem pro dvojvrstvu je defekt, jako je průchozí hydrofilní pór.
V lipidovém bimolekulárním filmu buněčné membrány se objevují póry, pokud vyloučíme čistě mechanické poškození, v důsledku teplotních výkyvů povrchu dvojvrstvy, elektrického rozpadu, zamrzání filmu, působení tenzidů, osmotického tlaku, peroxidace lipidů atd. Jedním z nejtypičtějších a dobře prostudovaných příkladů destabilizace biologických membrán je hemolýza erytrocytů. Tento jev zahrnuje počáteční fáze bobtnání buněk v hypotonickém prostředí v důsledku působení sil osmotického tlaku. Při bobtnání buněk se membrána natahuje, což způsobuje zvýšení membránového napětí. Při určité prahové úrovni napětí se objevují hydrofilní lipidové póry. Velikosti pórů jsou dostatečné pro uvolňování molekul hemoglobinu a nízkomolekulárních látek. Uvolňování látek je zase doprovázeno snížením rozdílu osmotického tlaku, přičemž se snižuje napětí membrány a dochází k zacelení pórů. Cytoskeletální proteiny umožňují červené krvince udržovat tvar a vzniká tzv. stín červené krvinky. Stín si zachovává osmotickou aktivitu a tím se proces destabilizace stává cyklickým. V tomto případě nedochází k úplné mechanické destrukci buňky, podobné mýdlové bublině. Při absenci cytoskeletu nebo jeho nedostatečném vývoji je mechanická pevnost buňky zcela určena osudem lipidových pórů. Pokud je pór menší než kritická velikost, pak se zahojí. Jinak neomezený růst pórů vede k destrukci membrány.
Model kritických pórů. Uvažujme model lipidového póru (obr. 15). Budeme předpokládat, že boční plocha póru má tvar kruhového válce. Kromě toho předpokládejme, že boční plocha válce je zakřivená a má poloměr zakřivení h/2. Poloměr pórů je r. Jak je vidět, lipidová dvojvrstva je obecně plochá a póry mají dva poloměry zakřivení h/2 a r. Zakřivení povrchu na rozhraní lipid-voda je doprovázeno výskytem dalšího tlaku, nazývaného Laplaceův tlak a rovného
P = 2s1/r
kde s 1 je mezipovrchové napětí uvnitř póru, r je poloměr zakřivení.
Obr. Struktura hydrofilního lipidového póru: h - tloušťka lipidové dvojvrstvy; h/2 - poloměr zakřivení stěny; r - poloměr pórů.
V uvažovaném modelu jsou dva takové poloměry (h/2 a r) a tedy dva tlaky. Jeden z nich P (h/2) podporuje expanzi a druhý P (r) podporuje kompresi pórů. Další osud póru závisí na poměru těchto dvou tlaků. Je-li P (h/2) > P (r), póry se rozšíří, a pokud je P (h/2) menší než P (r), póry budou proudit.
Uvažujme o energii póru. Jak bylo uvedeno výše, na hranici pórů působí dvě opačné síly, z nichž jedna, lineární okrajové napětí obvodu póru, podporuje růst póru, a druhá síla, povrchové napětí dvojvrstvy, způsobuje stlačení póru. . Okrajová energie póru je úměrná první mocnině poloměru a zvyšuje celkovou energii, energie povrchového napětí je úměrná druhé mocnině poloměru a snižuje celkovou energii. V důsledku toho je celková energie E (r) rovna
E(r) = 2pr 2s
kde první člen je určen energií okraje póru s lineárním napětím g a druhý člen energií povrchového napětí s.
S přihlédnutím k nestabilitě rovnováhy lze tvrdit, že výskyt pórů s r>r* (r*=g/s) se uzavře a stabilita membrány zůstane zachována. Toto je kritérium stability lipidové dvouvrstvé membrány.
Elektrický průraz membrány. Biologické membrány jsou vystaveny vysoce intenzivnímu elektrickému poli vytvořenému difúzí iontů přes membránu a elektrogenní iontové pumpy. Potenciální rozdíl mezi cytoplazmou a extracelulárním prostředím dosahuje asi 0,1 V, tloušťka membrány nepřesahuje 10 nm, což znamená, že intenzita pole je 10 7 V/m. Membrána je pokročilejší elektrický izolátor než mnoho kapalných izolátorů používaných v technologii. Membránový potenciál v živé buňce může dosáhnout 0,2 V (sladkovodní řasy, bakterie, mitochondrie nabité energií). U excitabilních nervových a svalových buněk dochází ke krátkodobé repolarizaci membrány se zvyšující se amplitudou potenciálu. Rozpad buněčné membrány vlastním membránovým potenciálem je však nepravděpodobný. Současně může nárůst membránového potenciálu v důsledku vystavení vnějšímu elektrickému poli dosáhnout hodnoty přesahující práh elektrického průrazu. V tomto případě se objevují strukturální defekty, jako jsou lipidové póry. Vyvinutá metoda elektrického rozpadu buněčných membrán byla tzv elektroporace a je široce používán v biotechnologiích.
Ve fyzice pod elektrický průraz rozumět prudkému nárůstu síly elektrického proudu v původně slabě vodivém prostředí. V živé buňce je takovým médiem bimolekulární lipidová vrstva. Pro lipidovou dvojvrstvu v kapalně krystalickém stavu nemůže být membránový potenciál menší než 0,23 V. Stabilita dvojvrstvých membrán je určena pravděpodobností výskytu pórů kritického poloměru. Je zřejmé, že jakýkoli faktor, který sníží výšku energetické bariéry, tuto pravděpodobnost zvýší. Mezi takové faktory patří snížení okrajové energie póru, zvýšení povrchového napětí a zvýšení membránového potenciálu. Elektrický rozpad je doprovázen výskytem široké škály lipidových pórů různých poloměrů, včetně poloměrů iontově selektivních proteinových kanálů. V současné době je metoda vystavení vnějšímu elektrickému poli jednou z hlavních v moderní biotechnologii. Je známo, že se používá ke zvýšení pórovitosti membrány (elektroporace), zavedení DNA (elektrotransfekce), uvolnění buněk z velkých molekul (elektropermeabilizace) a buněčné fúze (elektrofúze).
Teplotní fázový přechod membránových lipidů. Zmrznutí lipidové dvojvrstvy v důsledku fázového přechodu z kapalného krystalického stavu do gelu je doprovázeno objevením se lipidových pórů. Je zřejmé, že stejně jako v případě elektrického průrazu bude osud membrány určen poměrem poloměrů vytvořených pórů a kritických pórů pro tento stát dvouvrstvý.
Kritický poloměr póru ve stavu gelu je výrazně menší ve srovnání se stavem kapalných krystalů a nepřesahuje v absolutní hodnotě 2 nm. Zachování dlouhodobé stability lipidové dvojvrstvy ve stavu gelu ukazuje, že existující póry a póry vznikající během fázového přechodu mají velikost menší než 2 nm. Zmrznutí membránových lipidů během fázového přechodu je ekvivalentní elektrickému rozpadu membrány vnějším elektrickým polem 0,5 V. Jakýkoli vliv mechanického, fyzikálního popř. chemické povahy, ovlivňující povrchové napětí lipidové dvojvrstvy, je rizikovým faktorem při stabilizaci membrán obsahujících póry. Rozvoj tohoto přístupu umožňuje získat kvantitativní odpověď na biologicky důležitou otázku o pravděpodobnosti destrukce nebo hojení membrán za typických stresových podmínek živé buňky.
Kritický poloměr pórů v membránách v kapalném krystalickém stavu v nepřítomnosti vnější vlivy, dosahuje 9 nm. Tato hodnota je tak významná, že pravděpodobnost mechanického protržení buněčných membrán za fyziologických podmínek je velmi malá. Protržení membrány v tomto stavu je možné pouze tehdy, když pór nabude rozměrů úměrných tloušťce membrány. Zkušenosti ukazují, že úplná destrukce lipidové dvojvrstvy je možná pouze hrubými mechanickými manipulacemi nebo nevratným elektrickým rozpadem lipidů (gl), gelovým stavem (gel), elektrickým rozpadem (ep), při kombinaci stavu gelu s elektrickým rozpadem (gel + ep ).
Kritické velikosti pórů pro lipidovou dvojvrstvu v kapalném krystalickém stavu (9 nm) výrazně převyšují velikosti skutečných pórů. Membrány v různých napěťových podmínkách mají značnou rezervu bezpečnosti, vliv elektrického průrazu a zamrznutí dvojvrstvy je aditivní. Takový výsledek lze tedy očekávat při jiných kombinacích fyzikálních a chemických vlivů. Tímto způsobem lze v rámci uvažovaného modelu kvantitativně posoudit vliv stresu bez ohledu na jeho fyzikálně-chemickou povahu a předpovědět jeho výsledek. Model tvorby pórů během fázového přechodu. Nezávislý odhad velikosti pórů lze získat zkoumáním navrhovaného V.F. Antonov a spolupracovníci modelovali tvorbu pórů. Během fázového přechodu z kapalného krystalického stavu do gelu dochází podle rentgenové difrakční analýzy ke změně tloušťky dvojvrstvy a plochy na molekulu lipidu. Vezmeme-li v úvahu kooperativitu fázového přechodu, lze předpokládat, že molekuly v doménách, které přešly do gelové fáze a ty, které zůstaly v kapalném krystalickém stavu, budou za odlišných podmínek. Ve vztahu k rovnovážnému stavu budou molekuly v doméně gelové fáze nataženy a v kapalném krystalickém stavu budou stlačeny. Objeví se elastické napětí, které povede k narušení dvouvrstvé struktury.
Lipidové póry a propustnost membrány. Z hlediska permeability se lipidové póry zásadně liší od proteinových kanálů díky svému původu a výjimečné dynamice. Zatímco proteinové kanály mají přesně definované velikosti, které zůstávají po celou dobu životnosti buňky, velikosti lilidálních pórů během procesu úniku se značně liší. Nicméně tato variabilita; má limit. Pokud je poloměr pórů menší než kritický, pak musí pór v procesu proudění projít všemi středními poloměry a dosáhnout minimální velikosti. Otázka možnosti úplného úniku lipidových pórů zůstává otevřená. Předpokládá se, že úplnému stažení póru brání mohutné hydratační síly, které se projeví při přiblížení stěn hydrofilních pórů k sobě. Přirozené póry, na rozdíl od proteinových iontových kanálů, nemají výraznou selektivitu, což koreluje s jejich relativně velkými počátečními velikostmi. Je však zřejmé, že během procesu úniku mohou lipidové póry dosáhnout libovolně malých velikostí, včetně těch, které jsou srovnatelné s velikostí proteinových iontových kanálů, což může vést k redistribuci iontových proudů v membráně, například během excitace. . Dále je známo, že po vypnutí stresového efektu se dvouvrstvá lipidová membrána může vrátit do stavu s nízkou vodivostí, což znamená, že póry dosáhnou velikosti nedostatečné pro průchod hydratovaných iontů. Hydrofilní lipidové póry jsou tedy univerzální v tom, že je mohou buňky využít k transportu vysokomolekulárních látek, iontů a molekul vody.
Výzkum propustnosti lipidových pórů se v současnosti rozvíjí dvěma směry: v prvním jsou studovány největší póry, ve druhém naopak lipidové póry minimálního poloměru. V prvním případě hovoříme o elektro-transfekci – metodě vnášení molekul DNA do živých buněk nebo lipozomů za účelem přenosu a intracelulárního vnesení cizího genetického materiálu. Ukázalo se, že vnější elektrické pole vysoké napětí podporuje pronikání obří molekuly DNA do membránové částice. Maximální velikost Kritický pór odpovídá kapalnému krystalickému stavu lipidové dvojvrstvy v nepřítomnosti vnějšího elektrického pole a je roven 9 nm. Aplikace vnějšího elektrického pole 100 kV/m snižuje kritický poloměr pórů na 1 nm za 0,2 s. Jelikož jsou membrány zachovány, velikost lipidových pórů v nich nepřekračuje tuto spodní hranici. Paradoxem je, že efektivní průměr statistické cívky DNA, která by měla spadat dovnitř částice, dosahuje 2000 nm. Molekula DNA proto musí proniknout membránou ve formě nezkrouceného jednovlákna. Je známo, že konec nitě má průměr 2 nm a může tak vstoupit do póru pouze těsně. Volná difúze řetězce DNA v póru je však stěží možná. Mechanismus tohoto jevu bohužel není zcela jasný. Předpokládá se zejména, že molekula DNA je schopna rozšířit pór a tím proklouznout membránou. Průnik DNA může být usnadněn dodatečnými silami elektroforézy a elektroosmózy, s přihlédnutím k celkovému negativnímu náboji molekuly DNA. Je možné, že póry s v nich fixovanými konci molekuly DNA hrají roli kotvy držící molekulu na určitém místě blízko povrchu membrány vezikuly a samotný proces přenosu je typem pinocytózy. Studium tohoto zajímavého jevu z hlediska propustnosti pokračuje,
Druhý směr výzkumu membránové permeability za účasti lipidových pórů je spojen s transmembránovým přenosem molekul vody a iontů. Fenomén vysoké propustnosti buněčných membrán pro vodu, známý v biologii, je zcela reprodukován na umělých lipidových dvojvrstvách, což implikuje účast hydrofilních lipidových pórů v tomto procesu.
Hlavním závěrem je, že stabilita lipidové dvojvrstvy a buněčné membrány bez proteinového lešení je určena lipidovými póry. Tyto póry se tvoří v místech defektů ve struktuře tekutých krystalů lipidové dvojvrstvy. Lipidové póry vznikají jako důsledek tepelných fluktuací povrchu dvojvrstvy a mohou se také zrodit během membránového stresu doprovázejícího fázový přechod membránových lipidů, během elektrického rozpadu a osmotické lýzy. Osud membrány v těchto případech bude pravděpodobně záviset na tom, zda lipidový pór překročí určitou kritickou velikost či nikoliv. V prvním případě dojde k protržení membrány, ve druhém případě zůstane zachována její struktura. Při zachování stability membrán se póry hojí, přičemž procházejí všemi středními hodnotami poloměru. Minimální poloměry lipidových pórů se mohou stát srovnatelnými s velikostmi selektivních proteinových kanálů, které normálně regulují iontovou permeabilitu buněčných membrán. V posledních fázích nasávání se lipidové póry mohou změnit na vodní póry, přístupné pouze molekulám vody a iontům.
Buněčné membrány
Buněčné membrány
Obrázek buněčné membrány. Malé modré a bílé kuličky odpovídají hydrofilním hlavám lipidů a čáry k nim připojené odpovídají hydrofobním ocasům. Obrázek ukazuje pouze integrální membránové proteiny (červené globule a žluté šroubovice). Žluté oválné tečky uvnitř membrány - molekuly cholesterolu Žlutozelené řetězce kuliček na vnější straně membrány - řetězce oligosacharidů tvořící glykokalyx
Biologická membrána také zahrnuje různé proteiny: integrální (pronikající membránou), semiintegrální (ponořené na jednom konci do vnější nebo vnitřní lipidové vrstvy), povrchové (umístěné na vnější nebo přilehlé k vnitřním stranám membrány). Některé proteiny jsou body kontaktu mezi buněčnou membránou a cytoskeletem uvnitř buňky a buněčnou stěnou (pokud existuje) vně. Některé z integrálních proteinů fungují jako iontové kanály, různé transportéry a receptory.
Funkce biomembrán
- bariéra - zajišťuje regulovaný, selektivní, pasivní a aktivní metabolismus s okolím. Peroxisomová membrána například chrání cytoplazmu před peroxidy, které jsou pro buňku nebezpečné. Selektivní permeabilita znamená, že propustnost membrány pro různé atomy nebo molekuly závisí na jejich velikosti, elektrickém náboji a chemických vlastnostech. Selektivní permeabilita zajišťuje oddělení buňky a buněčných kompartmentů od prostředí a zásobení potřebnými látkami.
- transport - transport látek do a z buňky probíhá přes membránu. Transport přes membrány zajišťuje: dodávání živin, odstraňování konečných produktů metabolismu, sekreci různých látek, vytváření iontových gradientů, udržování vhodného pH a koncentrace iontů v buňce, které jsou nezbytné pro fungování buněčných enzymů.
Částice, které z jakéhokoli důvodu nejsou schopny projít fosfolipidovou dvojvrstvou (například kvůli hydrofilním vlastnostem, protože membrána uvnitř je hydrofobní a nepropouští hydrofilní látky, nebo kvůli velké velikosti), ale nezbytné pro buňku, mohou pronikat membránou prostřednictvím speciálních nosných proteinů (transportérů) a kanálových proteinů nebo endocytózou.
Při pasivním transportu látky procházejí lipidovou dvojvrstvou bez spotřeby energie, difúzí. Variantou tohoto mechanismu je usnadněná difúze, při které specifická molekula pomáhá látce projít membránou. Tato molekula může mít kanál, který umožňuje průchod pouze jednomu typu látky.
Aktivní transport vyžaduje energii, protože probíhá proti koncentračnímu gradientu. Na membráně jsou speciální pumpovací proteiny včetně ATPázy, která aktivně pumpuje draselné ionty (K+) do buňky a pumpuje z ní ionty sodíku (Na+).
- matrice - zajišťuje určitou relativní polohu a orientaci membránových proteinů, jejich optimální interakci;
- mechanická - zajišťuje autonomii buňky, jejích intracelulárních struktur, jakož i spojení s jinými buňkami (ve tkáních). Buněčné stěny hrají hlavní roli při zajišťování mechanické funkce a u zvířat mezibuněčná látka.
- energie - při fotosyntéze v chloroplastech a buněčném dýchání v mitochondriích fungují v jejich membránách systémy přenosu energie, na kterých se podílejí i bílkoviny;
- receptor - některé proteiny umístěné v membráně jsou receptory (molekuly, s jejichž pomocí buňka vnímá určité signály).
Například hormony cirkulující v krvi působí pouze na cílové buňky, které mají receptory odpovídající těmto hormonům. Neurotransmitery (chemické látky, které zajišťují vedení nervových vzruchů) se také vážou na speciální receptorové proteiny v cílových buňkách.
- enzymatické - membránové proteiny jsou často enzymy. Například plazmatické membrány buněk střevního epitelu obsahují trávicí enzymy.
- realizace generování a vedení biopotenciálů.
Pomocí membrány je v buňce udržována konstantní koncentrace iontů: koncentrace iontů K+ uvnitř buňky je mnohem vyšší než venku a koncentrace Na+ je mnohem nižší, což je velmi důležité, protože to zajišťuje udržování rozdílu potenciálů na membráně a generování nervového impulsu.
- značení buněk – na membráně jsou antigeny, které fungují jako markery – „štítky“, které umožňují buňku identifikovat. Jedná se o glykoproteiny (tj. proteiny s navázanými rozvětvenými oligosacharidovými postranními řetězci), které hrají roli „antén“. Kvůli nesčetným konfiguracím postranních řetězců je možné vytvořit specifický marker pro každý typ buňky. Pomocí markerů mohou buňky rozpoznat jiné buňky a jednat ve shodě s nimi, například při tvorbě orgánů a tkání. To také umožňuje imunitnímu systému rozpoznat cizí antigeny.
Struktura a složení biomembrán
Membrány se skládají ze tří tříd lipidů: fosfolipidy, glykolipidy a cholesterol. Fosfolipidy a glykolipidy (lipidy s připojenými sacharidy) se skládají ze dvou dlouhých hydrofobních uhlovodíkových ocasů, které jsou spojeny s nabitou hydrofilní hlavou. Cholesterol dodává membráně tuhost tím, že zabírá volný prostor mezi hydrofobními ocasy lipidů a brání jim v ohýbání. Membrány s nízkým obsahem cholesterolu jsou proto pružnější a membrány s vysokým obsahem cholesterolu pevnější a křehčí. Cholesterol také slouží jako „zátka“, která brání pohybu polárních molekul z buňky do buňky. Důležitou část membrány tvoří proteiny, které do ní pronikají a jsou zodpovědné za různé vlastnosti membrán. Jejich složení a orientace se u různých membrán liší.
Buněčné membrány jsou často asymetrické, to znamená, že se vrstvy liší složením lipidů, přechodem jednotlivé molekuly z jedné vrstvy do druhé (tzv. žabky) je obtížné.
Membránové organely
Jedná se o uzavřené jednotlivé nebo propojené úseky cytoplazmy, oddělené od hyaloplazmy membránami. Jednomembránové organely zahrnují endoplazmatické retikulum, Golgiho aparát, lysozomy, vakuoly, peroxisomy; na dvojité membrány - jádro, mitochondrie, plastidy. Vnějšek buňky je ohraničen tzv. plazmatickou membránou. Struktura membrán různých organel se liší složením lipidů a membránových proteinů.
Selektivní propustnost
Buněčné membrány mají selektivní permeabilitu: glukóza, aminokyseliny, mastné kyseliny, glycerol a ionty jimi pomalu difundují a membrány samy tento proces do jisté míry aktivně regulují – některé látky procházejí, jiné ne. Existují čtyři hlavní mechanismy pro vstup látek do buňky nebo jejich odstranění z buňky ven: difúze, osmóza, aktivní transport a exo- nebo endocytóza. První dva procesy jsou pasivní povahy, to znamená, že nevyžadují energii; poslední dva jsou aktivní procesy spojené se spotřebou energie.
Selektivní permeabilita membrány během pasivního transportu je způsobena speciálními kanály - integrálními proteiny. Pronikají skrz membránu a tvoří jakýsi průchod. Prvky K, Na a Cl mají své vlastní kanály. Vzhledem ke koncentračnímu gradientu se molekuly těchto prvků pohybují dovnitř a ven z buňky. Při podráždění se kanály sodíkových iontů otevřou a dojde k náhlému přílivu sodíkových iontů do buňky. V tomto případě dochází k nerovnováze membránového potenciálu. Poté se membránový potenciál obnoví. Draslíkové kanály jsou vždy otevřené, což umožňuje iontům draslíku pomalu vstupovat do buňky.
Odkazy
- Bruce Alberts a kol. Molekulární biologie buňky. - 5. vyd. - New York: Garland Science, 2007. - ISBN 0-8153-3218-1 - učebnice molekulární biologie v angličtině. Jazyk
- Rubin A.B. Biofyzika, učebnice ve 2 sv. . - 3. vydání, opravené a rozšířené. - Moskva: Moskevské univerzitní nakladatelství, 2004. - ISBN 5-211-06109-8
- Gennis R. Biomembrány. Molekulární struktura a funkce: překlad z angličtiny. = Biomembrány. Molekulární struktura a funkce (Robert B. Gennis). - 1. vydání. - Moskva: Mir, 1997. - ISBN 5-03-002419-0
- Ivanov V.G., Berestovskij T.N. Lipidová dvojvrstva biologických membrán. - Moskva: Věda, 1982.
- Antonov V.F., Smirnova E.N., Shevchenko E.V. Lipidové membrány při fázových přechodech. - Moskva: Věda, 1994.
viz také
- Vladimirov Yu. A., Poškození složek biologických membrán během patologických procesů
Nadace Wikimedia. 2010.
Podívejte se, co jsou „buněčné membrány“ v jiných slovnících:
Tento termín má jiné významy, viz Membrána Obrázek buněčné membrány. Malé modrobílé kuličky odpovídají hydrofilním „hlavám“ lipidů a čáry k nim připojené odpovídají hydrofobním „ocáskům“. Obrázek ukazuje... ... Wikipedii
- (z latinského membrana skin, membrána), složité vysoce organizované supramolekulární struktury, které vážou buňky (buněčné, resp. plazmatické membrány) a intracelulární organely, mitochondrie, chloroplasty, lysozomy atd. Představují ... ... Chemická encyklopedie
Tento termín má jiné významy, viz Membrána Obrázek buněčné membrány. Malé modrobílé kuličky odpovídají hydrofilním „hlavám“ lipidů a čáry k nim připojené odpovídají hydrofobním „ocáskům“. Obrázek ukazuje... ... Wikipedii
PROPUSTNOST- schopnost buněk a tkání absorbovat, vylučovat a transportovat chemické látky a procházet je buněčnými membránami, stěnami cév a epiteliálními buňkami. Živé buňky a tkáně jsou ve stavu nepřetržité chemické výměny. látek s prostředím. Hlavní bariérou (viz Bariérové funkce) pohybu látek je buněčná membrána. Proto byly historicky P. mechanismy studovány souběžně se studiem struktury a funkce biologických membrán (viz Biologické membrány).
Existují pasivní P., aktivní transport látek a zvláštní případy P. spojené s fagocytózou (viz) a pinocytózou (viz).
V souladu s membránovou teorií P. vychází pasivní P. z různé druhy difúze látky přes buněčné membrány (viz Difúze
kde dm je množství látky difundující za dobu dt přes plochu S; dc/dx je koncentrační gradient látky; D je difúzní koeficient.
Rýže. 1. Molekulární organizace ionoforového antibiotika (valinomycin): a - strukturní vzorec molekuly valinomycinu obsahující šest pravotočivých (D) a šest levotočivých (L) aminokyselin, všechny postranní skupiny [-CH3-CH(CH3)2] jsou hydrofobní; b - schematické znázornění prostorové konfigurace valinomycinového komplexu s draselným iontem (uprostřed). Některé z karbonylových skupin komplexu tvoří vodíkové vazby s atomy dusíku, zatímco jiné tvoří koordinační vazby s kationtem (draselný iont). Hydrofobní skupiny tvoří vnější hydrofobní sféru komplexu a zajišťují jeho rozpustnost v uhlovodíkové fázi membrány; 1 - atomy uhlíku, 2 - atomy kyslíku, 3 - kationt (draselný iont), 4 - atomy dusíku, 5 - vodíkové vazby, 6 - koordinační vazby. Draslíkový iont „zachycený“ molekulou valinomycinu je touto molekulou transportován přes buněčnou membránu a uvolňován. Tímto způsobem je zajištěna selektivní permeabilita buněčné membrány pro ionty draslíku.
Při studiu permeability buněk pro rozpuštěnou látku místo koncentračního gradientu používají koncept rozdílu koncentrací difundující látky na obou stranách membrány a místo difúzního koeficientu používají koeficient propustnosti. (P), což také závisí na tloušťce membrány. Jedním z možných způsobů pronikání látek do buněk je jejich rozpouštění v lipidech buněčných membrán, což je potvrzeno existencí přímo úměrného vztahu mezi koeficientem permeability velké třídy chemikálií. sloučenin a distribučního koeficientu látky v systému olej-voda. Voda se přitom této závislosti neřídí, její penetrační rychlost je mnohem vyšší a není úměrná distribučnímu koeficientu v systému olej-voda. Pro vodu a v ní rozpuštěné nízkomolekulární látky je nejpravděpodobnější metodou P. průchod membránovými póry. K difúzi látek přes membránu tedy může dojít rozpuštěním těchto látek v lipidech membrány; průchodem molekul polárními póry tvořenými polárními, nabitými skupinami lipidů a proteinů, jakož i průchodem póry bez náboje. Speciální typy usnadňují a výměnnou difúzi, kterou zajišťují proteiny a v tucích rozpustné nosné látky, které jsou schopny vázat transportovanou látku na jedné straně membrány, difundovat s ní přes membránu a uvolňovat ji na druhé straně membrány. Rychlost přenosu látky přes membránu je v případě usnadněné difúze mnohem vyšší než u prosté difúze. Roli specifických přenašečů iontů mohou plnit některá antibiotika (valinomycin, nigericin, monensin a řada dalších), nazývaná ionofory (viz Ionofory). Molekulární organizace komplexů ionoforových antibiotik s kationty byla dešifrována. V případě valinomycinu (obr. 1) se ukázalo, že po navázání na draselný kation změní molekula peptidu konformaci a získá vzhled náramku s vnitřním průměrem cca. 0,8 nm, ve kterém je draslíkový ion zadržen v důsledku interakcí ion-dipól.
Běžným typem pasivního P. buněčných membrán pro polární látky je P. přes póry. Přestože přímé pozorování pórů v lipidové vrstvě membrány je obtížné, experimentální data naznačují jejich skutečnou existenci. Skutečnou existenci pórů podporují i údaje o osmotických vlastnostech buněk. Hodnotu osmotického tlaku v roztocích obklopujících buňku lze vypočítat pomocí vzorce:
π=σ CRT,
kde π je osmotický tlak; C je koncentrace rozpuštěné látky; R - plynová konstanta; T - absolutní teplota; σ - koeficient odrazu. Pokud je rychlost průchodu molekuly rozpuštěné látky membránou srovnatelná s rychlostí průchodu molekul vody, pak se velikosti sil budou blížit nule (nedojde k osmotické změně objemu buňky); pokud je buněčná membrána pro danou látku nepropustná, pak má hodnota σ tendenci k 1 (osmotická změna objemu buňky je maximální). Rychlost pronikání molekul přes buněčnou membránu závisí na velikosti molekuly a tedy výběrem molekul určité velikosti a pozorováním změny objemu buněk v roztoku dané látky velikost buněčných pórů. lze určit. Například membrána axonu olihně je slabě propustná pro molekuly glycerolu, které mají poloměr cca. 0,3 nm, ale propustné pro látky s menší velikostí molekul (tabulka). Podobné experimenty s jinými buňkami ukázaly, že velikosti pórů v buněčných membránách, zejména v membránách erytrocytů, Escherichia coli, střevních epiteliálních buněk atd., spadají poměrně přesně do rozmezí 0,6-0,8 nm.
Živé buňky a tkáně se vyznačují dalším způsobem průniku látek do buňky a z buňky - aktivním transportem látek. Aktivní transport je přenos látky přes buněčnou (nebo intracelulární) membránu (transmembránový aktivní transport) nebo přes vrstvu buněk (transcelulární aktivní transport), probíhající proti elektrochemickému gradientu (viz Gradient). tj. s výdejem volné energie těla (viz Metabolismus a energie). Molekulární systémy odpovědné za aktivní transport látek se nacházejí v buněčné (nebo intracelulární) membráně. V cytoplazmatických membránách buněk zapojených do aktivního transportu iontů - svalové buňky, neurony, erytrocyty, ledvinové buňky - se ve významném množství nachází enzym Na+, nezávislá ATPáza, která se aktivně podílí na mechanismech transportu iontů (viz Ion doprava). Mechanismus fungování tohoto enzymu byl nejvíce studován v erytrocytech a axonech, které mají výraznou schopnost akumulovat draselné ionty a odstraňovat (odčerpávat) sodíkové ionty. Předpokládá se, že červené krvinky obsahují molekulární zařízení – draslíkovo-sodnou pumpu (draslík-sodná pumpa), která zajišťuje selektivní absorpci draselných iontů a selektivní odstraňování sodných iontů z buňky a hlavním prvkem této pumpy je Na +, K + -ATPáza. Studium vlastností enzymu ukázalo, že enzym je aktivní pouze v přítomnosti draselných a sodných iontů a sodné ionty aktivují enzym z cytoplazmy a draselné ionty z okolního roztoku. Specifickým inhibitorem enzymu je srdeční glykosid ouabain. Byly také objeveny další transportní ATPázy, zejména ty transportující Ca +2 ionty.
V membránách mitochondrií je znám molekulární systém, který zajišťuje čerpání vodíkových iontů - enzym H + -ATPáza a v membránách sarkoplazmatického retikula - enzym Ca ++ -ATPáza. Mitchell (P. Mitchell), autor chemiosmotické teorie oxidativní fosforylace v mitochondriích (viz Fosforylace), zavedl koncept „sekundárního transportu látek“, který se uskutečňuje díky energii membránového potenciálu a (nebo) gradient pH. Jestliže pro iontové ATPázy protigradientní pohyb iontů a využití ATP zajišťuje stejný enzymový systém, pak v případě sekundárního aktivního transportu jsou tyto dva děje zajišťovány různými systémy a lze je oddělit v čase a prostoru.
Průnik velkých proteinových makromolekul a nukleových kyselin do buněk. buněčné enzymy a celé buňky se uskutečňují mechanismem fagocytózy (zachycení a absorpce velkých pevných částic buňkou) a pinocytózy (zachycení a absorpce části buněčného povrchu okolní kapaliny s látkami v ní rozpuštěnými).
P. buněčné membrány jsou důležitější pro fungování buněk a tkání.
Aktivní transport iontů a doprovodná absorpce vody v buňkách renálního epitelu probíhá v proximálních tubulech ledviny (viz Ledviny). Ledvinami dospělého člověka denně projde až 1800 litrů krve. Bílkoviny se odfiltrují a zůstanou v krvi, 80 % solí a vody se stejně jako veškerá glukóza vrátí do krevního oběhu. Předpokládá se, že hlavní příčinou tohoto procesu je transcelulární aktivní transport sodných iontů, zajišťovaný Na+ K+-dependentní ATPázou lokalizovanou v buněčných membránách bazálního epitelu. Pokud je v lůžku renálního proximálního tubulu koncentrace sodných iontů cca. 100 mmol/l, uvnitř buňky pak nepřesahuje 37 mmol/l; V důsledku toho je pasivní tok sodných iontů nasměrován do buňky. Pasivní průnik kationtů do cytoplazmy je rovněž usnadněn přítomností membránového potenciálu (vnitřní povrch membrány je záporně nabitý). Že. sodíkové ionty pronikají do buňky pasivně v souladu s koncentračními a elektrickými gradienty (viz Gradient). K uvolňování iontů z buňky do krevní plazmy dochází proti koncentračním a elektrickým gradientům. Bylo zjištěno, že sodíkovo-draslíková pumpa je umístěna v bazální membráně, která zajišťuje odstranění sodných iontů. Předpokládá se, že anionty chloru se po sodíkových iontech pohybují mezibuněčným prostorem. V důsledku toho se zvyšuje osmotický tlak krevní plazmy a voda z tubulárního řečiště se začíná dostávat do krevní plazmy, čímž je zajištěna reabsorpce soli a vody v renálních tubulech.
Ke studiu pasivního a aktivního P se používají různé metody. Metoda značených atomů se rozšířila (viz Izotopy, Radioaktivní drogy, Výzkum radioizotopů). Ke studiu iontového metabolismu buněk se využívají izotopy 42 K, 22 Na a 24 Na, 45 Ca, 86 Rb, 137 Cs, 32 P a další; ke studiu P. vody - deuteriová nebo tritiová voda, stejně jako voda značená kyslíkem (18O); pro studium metabolismu cukrů a aminokyselin - sloučeniny značené uhlíkem 14 C nebo sírou 35 S; pro studium P. proteinů - jodované přípravky značené 1 31 I.
Vitální barviva jsou široce používána ve výzkumu P. Podstatou metody je pozorovat pod mikroskopem rychlost průniku molekul barviva do buňky. U většiny životně důležitých barviv (neutrální červeň, methylenová modř, rhodamin atd.) se pozorování provádějí ve viditelné části spektra. Používají se i fluorescenční sloučeniny a mezi ně patří fluorescein sodný, chlortetracyklin, murexid aj. Při studiu svalů se ukázalo, že absorpce molekul barviva závisí nejen na vlastnostech buněčné membrány, ale také na sorpční kapacitě intracelulární struktury, nejčastěji proteiny a nukleové kyseliny.-t, se kterými se vážou barviva.
Ke studiu P. vody a látek v ní rozpuštěných se používá osmotická metoda. V tomto případě je pomocí mikroskopu nebo měřením rozptylu světla suspenze částic pozorována změna objemu buněk v závislosti na tonicitě okolního roztoku. Pokud je buňka v hypertonickém roztoku, pak voda z ní přechází do roztoku a buňka se smršťuje. Opačný účinek je pozorován u hypotonického roztoku.
Ke studiu vodivosti buněčných membrán se stále častěji používají potenciometrické metody (viz metoda výzkumu mikroelektrod, Elektrická vodivost biologických systémů); široká škála iontově specifických elektrod umožňuje studovat kinetiku transportu mnoha anorganických iontů (draslík, sodík, vápník, vodík atd.), stejně jako některých organických iontů (acetáty, salicyláty atd.). Všechny typy membrán buněk P. jsou do té či oné míry charakteristické pro mnohobuněčné membránové systémy tkání – stěny krevních cév, epitel ledvin a sliznice střev a žaludku. Současně se vaskulární P. vyznačuje některými znaky, které se projevují porušením vaskulárního P. (viz níže).
Patologická fyziologie cévní permeability
Termínem „vaskulární permeabilita“ se označoval histohematický a transkapilární metabolismus, distribuce látek mezi krví a tkáněmi, tkáňový P., hemolymfatický přenos látek a další procesy. Někteří vědci používají tento termín k označení trofické funkce kapilárně-pojivových tkáňových struktur. Nejednoznačnost v použití termínu byla jedním z důvodů protichůdných názorů na řadu otázek, zejména souvisejících s regulací cévního P. V 70. letech. 20. století termín „vaskulární permeabilita“ začal používat Ch. arr. k označení selektivní permeability neboli bariérové transportní funkce stěn krevních mikrocév. Je tendence řadit mezi cévní P. i P. stěny nejen mikrocév (krevních a lymfatických), ale i velkých cév (až aorty).
Jsou pozorovány změny vaskulárního P.. arr. ve formě zvyšující se selektivní P. pro makromolekuly a krvinky. Typickým příkladem toho je exsudace (viz). Pokles vaskulárního P. je spojen především s impregnací bílkovin a následným zhutněním cévních stěn, což je pozorováno např. u hypertenze (viz).
Panuje názor na možnost narušení P. cévní stěny hlavně směrem do intersticia nebo z intersticia do krve. Preferenční pohyb látek tím či oním směrem vůči cévní stěně však zatím neprokazuje jeho souvislost se stavem bariérově-transportní funkce cévní stěny.
Principy studia poruch cévní permeability
Posouzení stavu cévního P. je nutno provádět s přihlédnutím k tomu, že cévní stěna zajišťuje vymezení a funkční spojení dvou sousedních prostředí (krev a intersticiálního prostředí), které jsou hlavními složkami vnitřního prostředí cévní stěny. tělo (viz). Výměna mezi těmito přilehlými prostředími se zpravidla uskutečňuje díky mikrohemocirkulaci (viz Mikrocirkulace) a cévní stěna se svou bariérově-transportní funkcí působí pouze jako základ orgánové specializace histohematické výměny. Metodu pro studium stavu vaskulárního P. lze proto považovat za adekvátní pouze tehdy, když umožňuje hodnotit kvalitativní parametry histohematického metabolismu s přihlédnutím k jejich orgánové specifičnosti a bez ohledu na stav orgánové mikrohemocirkulace a povahu metabolických procesů. které se tvoří mimo cévní stěnu. Z tohoto pohledu je ze stávajících metod nejadekvátnější metoda elektronového mikroskopu pro studium cévního P., která umožňuje přímo sledovat cesty a mechanismy pronikání látek cévní stěnou. Obzvláště plodná byla kombinace elektronové mikroskopie s tzv. tracerové indikátory neboli tracery, označující dráhy jejich pohybu cévní stěnou. Jako takové indikátory lze použít jakékoli netoxické látky detekované pomocí elektronové mikroskopie nebo speciálních technik (histochemicky, autorradiograficky, imunocytochemicky atd.). K tomuto účelu se používá železo obsahující protein feritin, různé enzymy s peroxidázovou aktivitou, koloidní uhlík (purifikovaný černý inkoust) atd.
Z nepřímých metod studia stavu bariérově-transportní funkce stěn cév je nejrozšířenější registrace průniku přes cévní stěnu přirozených nebo umělých indikátorů, které stěnou za normálních podmínek slabě nebo nepronikají. Pokud dojde k narušení mikrohemocirkulace, což je často pozorováno u vaskulárních P., mohou být tyto metody neinformativní a pak by měly být kombinovány například s metodami sledování stavu mikrohemocirkulace. pomocí biomikroskopie nebo snadno difuzních indikátorů, jejichž histohematický metabolismus nezávisí na stavu cévního P. a metabolismu tkání. Nevýhodou všech nepřímých metod založených na zaznamenávání akumulace indikátorových látek mimo cévní řečiště je nutnost zohlednit řadu faktorů, které mohou významně ovlivnit hladinu indikátoru ve studované oblasti. Tyto metody jsou navíc spíše inertní a neumožňují studovat krátkodobé a reverzibilní změny vaskulárního P., zejména v kombinaci se změnami mikrocirkulace. Tyto obtíže lze částečně překonat pomocí metody označené cévy, která je založena na stanovení průniku do cévní stěny slabě difuzního indikátoru, který se hromadí ve stěně a barví ji. Obarvené (označené) oblasti jsou detekovány pomocí světelného mikroskopu a jsou důkazem poškození endotelu. Jako indikátor lze použít koloidní uhlík, který tvoří snadno detekovatelné tmavé nahromadění v místech hrubého porušení endoteliální bariéry. Změny v aktivitě mikrovezikulárního transportu touto metodou nejsou zaznamenávány a je nutné použít další indikátory transportované endotelem mikrovezikuly.
Možnosti studia vaskulárních poruch P. v klinickém prostředí jsou omezenější, protože většina metod založených na použití mikromolekulárních snadno difuzních indikátorů (včetně radioizotopů) neumožňuje jednoznačné posouzení stavu bariérově-transportní funkce stěn. krevních cév.
Poměrně široce používaná metoda je založena na stanovení kvantitativních rozdílů v obsahu bílkovin ve vzorcích arteriální a venózní krve odebraných současně (viz Landisův test). Při výpočtu procenta ztráty bílkovin v krvi při jejím přechodu z tepenného do žilního řečiště je nutné znát procento ztráty vody, které je určeno rozdílem hematokritu arteriální a venózní krve. Ve svém výzkumu o zdravých lidí V. P. Kaznacheev a A. A. Dzizinsky (1975) odvodili následující hodnoty jako ukazatele normálního P. cév horní končetiny: pro vodu průměrně 2,4-2,6 %, pro bílkoviny 4-4,5 %, t.j. při 100 ml krev prochází cévním řečištěm do lymfy. kanál teče cca. 2,5 ml vody a 0,15-0,16 g bílkovin. V lidském těle by se tak denně mělo vytvořit minimálně 200 litrů lymfy, což je desítkykrát více, než je skutečné množství denní produkce lymfy v těle dospělého člověka. Nevýhodou metody je samozřejmě předpoklad, že rozdíly v hematokritu arteriální a venózní krve jsou podle Kroma vysvětlovány pouze změnou obsahu vody v krvi v důsledku jejího uvolňování mimo cévní řečiště.
V klínu. V praxi je stav regionálního vaskulárního P. často posuzován podle přítomnosti intersticiálních nebo dutinových akumulací volné tekutiny bohaté na proteiny. Při posuzování stavu cévního P. však např. v dutině břišní lze vyvodit chybný závěr, protože metabolické mikrocévy těchto orgánů a tkání se normálně vyznačují vysokým P. pro makromolekuly v důsledku diskontinuity nebo porozity jejich endotelu. Zvýšení filtračního tlaku v takových případech vede k tvorbě výpotku bohatého na bílkoviny. Venózní dutiny a sinusoidy jsou zvláště propustné pro proteinové molekuly.
Je třeba poznamenat, že zvýšené uvolňování plazmatických bílkovin do tkáně a rozvoj tkáňového edému (viz) nemusí vždy doprovázet zvýšení vaskulárního P. Mikrocévy (kapiláry a venuly), jejichž endotel je za normálních okolností špatně propustný pro makromolekuly získat endoteliální defekty; Těmito defekty se do subendoteliálního prostoru snadno dostávají indikátory zavedené do krevního řečiště – makromolekuly a mikročástice. Nejsou však žádné známky otoku tkání – tzv. needematózní forma poruchy vaskulární permeability. Podobný jev je pozorován např. ve svalech zvířat při rozvoji neurodystrofického procesu v nich spojeného s transekcí motorického nervu. Podobné změny v lidských tkáních byly popsány např. při stárnutí a diabetes mellitus, kdy tzv acelulární kapiláry, tj. výměna mikrocév s částečně nebo úplně deskvamovanými endoteliálními buňkami (také nejsou žádné známky edému tkáně). Všechny tyto skutečnosti svědčí na jedné straně o relativitě souvislosti mezi tkáňovým otokem a zvýšením krevního tlaku v cévách a na straně druhé o existenci extravaskulárních mechanismů odpovědných za distribuci vody a látek mezi krví a tkáněmi.
Faktory ovlivňující vaskulární permeabilitu
Faktory ovlivňující vaskulární permeabilitu se konvenčně dělí do dvou skupin: exogenní a endogenní. Exogenní faktory cévních poruch P. různé povahy (fyzikální, chemické atd.) se zase dělí na faktory, které přímo ovlivňují cévní stěnu a její bariérově-transportní funkci, např. histamin vpravený do cévního řečiště, různé toxiny, atd. .), a faktory P. porušení nepřímé akce, jejíž účinek je zprostředkován prostřednictvím endogenních faktorů.
K již známým endogenním faktorům vaskulárních poruch P. (histamin, serotonin, kininy) se začalo zařazovat velké množství dalších, zejména prostaglandiny (viz), a ty nejen zvyšují vaskulární P., ale zesilují účinek dalších faktory; mnoho endogenních faktorů je produkováno různými krevními enzymovými systémy (systém Hagemanova faktoru, systém komplementu atd.).
Zvyšují vaskulární P. a imunitní komplexy. Yoshinaga (1966) izoloval pseudoglobulin z faktoru zodpovědného za „opožděné“ zvýšení vaskulárního P. během rozvoje fenoménu Arthus; Kuroyanagi (1974) objevil nový faktor P., který označil jako Ig-PF. Svými vlastnostmi se výrazně liší od histaminu, kininů, anafylatoxinu a kalikreinu, působí déle než histamin a bradykinin a je inhibován vitamíny K1 a K2.
Mnoho faktorů ovlivňujících vaskulární P. je produkováno leukocyty. Proteáza je tedy spojena s povrchem neutrofilů a tvoří neutrální peptidový mediátor z plazmatických proteinů, který zvyšuje vaskulární P. Proteinový substrát proteázy má mol. hmotnost (hmotnost) 90 000 a liší se od kininogenu.
Lysozomy a specifická granula krvinek obsahují kationtové proteiny, které mohou narušit vaskulární P. Jejich působení je zprostředkováno histaminem žírných buněk.
Různé endogenní faktory vaskulární poruchy P. působí v tkáních současně nebo postupně a způsobují zánět. cévní P. fázové posuny. V tomto ohledu se rozlišují časné, opožděné a pozdní změny v cévním P. Časná fáze je fází působení histaminu (viz) a serotoninu (viz). Druhá fáze se rozvíjí po období imaginární pohody, 1-3 hodiny po počátečním zranění - pomalá nebo opožděná fáze; jeho vývoj je dán působením kininů (viz) nebo prostaglandinů. Vývoj těchto dvou fází závisí na hladině komplementu a je inhibován antikomplementárním imunitním sérem. Den po poranění se rozvine třetí fáze spojená s působením cyto- a proteolytických enzymů uvolňovaných z lysozomů leukocytů a lymfocytů. V závislosti na povaze primárního škodlivého činidla se může počet fází lišit. V časné fázi je narušena cévní P.. arr. na úrovni venul se v dalších fázích proces šíří do kapilárního řečiště a arteriol.
Příjem faktorů permeability cévní stěnou. Endogenní faktory poruch P. představují nejvýznamnější skupinu příčin cévních poruch P. Některé z nich se v hotové formě nacházejí v tkáních (histamin, serotonin) a vlivem různých patogenních vlivů se uvolňují z depa, které hrají žírné buňky a krvinky (bazofily, krevní destičky). Další faktory jsou produktem různých biochemikálií. systémů jak v místě primárního poškození, tak ve vzdálenosti od něj.
Otázky původu P. faktorů jsou samy o sobě důležité pro řešení praktických problémů prevence a léčby cévních poruch P. Objevení P. faktoru však zatím nestačí k narušení cévního P. Aby P. faktor mohl stát se skutečným faktorem vaskulárních poruch P., musí být „postřehnut“, to znamená, že ho cévní stěna dostane (pokud nemá destrukční schopnost jako cytolytická činidla). Je například známo, že histamin zavedený do celkového krevního řečiště narušuje cévní P. pouze v určitých orgánech a tkáních, zatímco v jiných tkáních (mozek, plicní tkáň, endoneurium atd.) není účinný. U žab zavedení serotoninu a bradykininu do cévního řečiště nezpůsobí narušení cévního P. Důvody neúčinnosti histaminu jsou však v obou případech odlišné.
Podle moderních údajů je endotel metabolických mikrocév u teplokrevných živočichů a člověka citlivý na velké množství různých činitelů, to znamená, že se vyznačuje vysokou receptorovou kapacitou. Pokud jde o histamin, jeden z hlavních faktorů P., způsobující akutní a významnou (i když krátkodobou) poruchu vaskulárního P., experimentální údaje ukazují na přítomnost dvou typů histaminových receptorů H1 a H2, které hrají v endotelu. různé role v mechanismu účinku histaminu. Právě stimulace H1 receptorů vede k vaskulární dysfunkci, která je charakteristická pro působení histaminu.
Pod vlivem některých endogenních faktorů P., zejména histaminu, je pozorována tachyfylaxe (viz) a opakované použití (po 30 minutách) přípravku již nenarušuje cévní P. Taková dočasná necitlivost mikrovaskulárního endotelu se nevysvětluje přechodným blokáda odpovídajících receptorů, i když v některých případech tomu tak může být. V případě histaminu má mechanismus tachyfylaxe podle některých informací nereceptorovou lokalizaci. Dokazuje to zejména skutečnost rozvoje zkřížené tachyfylaxe, kdy užívání histaminu vede k rozvoji endoteliální rezistence nejen vůči histaminu samotnému, ale i solím lanthanu, které obcházejí receptory. Výskyt zkřížené tachyfylaxe může být jednou z příčin neúčinnosti jednotlivých P. faktorů působících současně nebo následně.
Ultrastrukturní podstata a efektorové mechanismy poruch cévní permeability
Rýže. 2. Dráhy a mechanismy transkapilárního metabolismu za normálních podmínek (a) a patologie (b): 1 - transcelulární difúze; 2 - difúze a ultrafiltrace v oblasti těsných mezibuněčných spojů; 3 - difúze a ultrafiltrace v oblasti jednoduchých mezibuněčných spojení; 4 - mikrovezikulární transport obcházející těsné mezibuněčné spoje; 3a a 4a - patologické mezibuněčné kanály, jako jsou „histaminové mezery“; 5 - mikrovezikulární transport; 6 - vytvoření transcelulárního kanálu fúzí mikrovezikul; 7 - fagocytární vakuoly v pericytech; 8 - mikročástice indikátoru vaskulární permeability (BM - bazální membrána, EN1, EN2, EN3 - endoteliální buňky, PC - pericyty).
Studie elektronového mikroskopu odhalily, že morfol. základem pro zvýšení vaskulárního P. je tvorba širokých kanálů v oblasti mezibuněčných spojení v endotelu (obr. 2). Takové kanály nebo „úniky“ se často nazývají histaminové mezery, protože jejich tvorba je typická pro působení histaminu na cévní stěnu a byla poprvé podrobně studována právě během jeho působení. Vznikají histaminové mezery. arr. ve stěnách venul těch orgánů a tkání, kde nejsou nízkopermeabilní histogematické bariéry jako je hematoencefalická bariéra apod. Lokální diskrepance v mezibuněčných kontaktech byly zjištěny u neuroregulačních poruch, mechanických, tepelných, chemických a jiných typů poškození tkáně, působením různých bioregulátorů (serotonin, bradykinin, prostaglandiny E1 a E2 atd.). K narušení mezibuněčných kontaktů dochází, i když s velkými obtížemi, v kapilárách a arteriolách a dokonce i ve větších cévách. Snadnost tvorby histaminových mezer je přímo úměrná počáteční strukturální slabosti mezibuněčných spojení, okraj se zvětšuje při přechodu z arteriol do kapilár a z kapilár do venul, maxima dosahuje na úrovni postkapilárních (pericytických) venul.
Neúčinnost histaminu při rozrušování cévních P. některých orgánů je dobře vysvětlena právě z hlediska vývoje těsných spojení v endotelu mikrocév těchto orgánů např. mozek
Z teoretického i praktického hlediska je důležitá otázka efektorových mechanismů, které jsou základem vzniku strukturálních defektů, jako jsou histaminové mezery. Tyto ultrastrukturální změny jsou typické právě pro počáteční fázi akutního zánětu (viz), kdy je podle I. I. Mečnikova (1891) biologicky vhodné zvýšení vaskulárního P., protože to zajišťuje zvýšené uvolňování fagocytů do místa poškození. Lze dodat, že zvýšený výtěžek plazmy v takových případech je také vhodný, protože v tomto případě jsou protilátky a nespecifická ochranná činidla dodávána na místo. Zvýšení vaskulárního P. v ohnisku zánětu lze tedy považovat za specifický stav bariérově-transportní funkce stěn mikrocév adekvátní novým podmínkám existence tkání a změnu vaskulárního P. při zánětech a podobných situacích - ne jako porušení, ale jako nový funkční stav, který přispívá k obnově narušené tkáňové homeostázy. Je třeba vzít v úvahu, že v některých orgánech (játra, slezina, kostní dřeň), kde v souladu s charakteristikou orgánových funkcí probíhá nepřetržitý metabolický tok buněk a makromolekul, jsou mezibuněčné „úniky“ normální a trvalé formace. , představující přehnané histaminové mezery, ale na rozdíl od skutečných histaminových mezer jsou schopné dlouhodobé existence. Skutečné histaminové mezery se tvoří hned v prvních sekundách po vystavení endotelu mediátorům akutního zánětu a většinou po 10-15 minutách. se zavírají. Mechanismus tvorby histaminových mezer je ochranný, fylogeneticky determinovaný a spojený se stereotypní reakcí na buněčné úrovni, spouštěnou stimulací odlišné typy receptory.
Povaha této stereotypní reakce zůstala dlouho neprozkoumaná. I. I. Mechnikov se domníval, že zvýšení vaskulárního P. během zánětu je spojeno s redukcí endoteliálních buněk. Později se však zjistilo, že endoteliální buňky v cévách teplokrevných živočichů nepatří do kategorie buněk, které aktivně mění svůj tvar jako buňky svalové. Rowley (D. A. Rowley, 1964) navrhl, že divergence endoteliálních buněk je důsledkem zvýšeného intravaskulárního tlaku a souvisejícího přetažení endotelu. Přímá měření prokázala nepřijatelnost této hypotézy ve vztahu k venulám a kapilárám, nicméně pro arteriální cévy má určitou hodnotu, protože při narušení tonické aktivity svalové vrstvy může vysoký intravaskulární tlak skutečně způsobit přetažení endotelu a poškození mezibuněčných kontaktů. Ale ani v tomto případě není výskyt histaminových mezer v intimě vždy spojen s působením transmurálního tlaku. Robertson a Khairallah (A. L. Robertson, P. A. Khairallah, 1972) v pokusech na izolovaném segmentu břišní aorty králíka ukázali, že se vlivem angiotenzinu II tvoří široké mezery v endotelu v místech zaoblení a zkrácení endoteliálních buněk. Podobný morfol. změny byly nalezeny i v endotelu metabolických mikrocév kůže při lokální aplikaci angiotenzinu II, prostaglandinu E1 a sérových triglyceridů.
O. V. Alekseev a A. M. Chernukh (1977) objevili schopnost endotelových buněk metabolických mikrocév rychle zvyšovat obsah mikrofibrilárních struktur v cytoplazmě, podobných svým morfolem. znaky s aktinovými mikrofilamenty. Tento reverzibilní jev (tzv. fenomén operační strukturizace mikrofibrilárního aparátu) se rozvíjí pod vlivem faktorů, které způsobují vznik širokých mezibuněčných mezer. Reverzibilita jevu v případě užívání histaminu ztěžuje identifikaci a dobře vysvětluje krátké trvání a reverzibilitu existence histaminových mezer. Pomocí cytochalasinu-B, který blokuje tvorbu aktinových mikrofibril, je odhalen patogenetický význam tohoto jevu v mechanismu tvorby mezibuněčných histaminových mezer. Tyto skutečnosti naznačují, že endoteliální buňky mají latentní kontrakci, která se realizuje v podmínkách, kdy je předchozí úroveň vaskulárního P. nedostatečná a je nutná relativně rychlá a reverzibilní změna. Změna vaskulárního P. působí tedy jako zvláštní akt biol. regulace, zajišťující přizpůsobení bariérově-transportní funkce cévního endotelu v souladu s novými místními potřebami, které naléhavě vyvstaly v souvislosti se změnami životních podmínek tkáně.
Přítomnost ve tkáních mechanismu pro změnu vaskulárního P. lze přičíst tzv. rizikové faktory, neboť aktivace tohoto mechanismu v neadekvátních podmínkách může způsobit narušení tkáňové homeostázy a orgánových funkcí, nikoli projev působení adaptačních a ochranných mechanismů. Hlavní způsoby porušení vaskulárního P. jsou uvedeny v diagramu. Změny vaskulárního P. jsou založeny na mechanismech, které vedou nejen k tvorbě mezibuněčných kanálů (histaminové mezery), ale ovlivňují i aktivitu buněčného povrchu (tj. mikrovezikulace a mikrovezikulární transport, vakuolizace a tvorba mikrobublinek). Výsledkem může být perforace endoteliálních buněk s tvorbou více či méně rozsáhlých a dlouhotrvajících transcelulárních kanálů.
Velký význam v mechanismech cévního P. je přikládán lokálním změnám povrchového elektrického náboje, zejména na membránách, které uzavírají póry v fenestrovaných kapilárách (např. ledvinové glomeruly). Podle některých údajů může být základem pro zvýšení uvolňování proteinů z glomerulárních kapilár pouze změna náboje. Že. omezení teorie pórů jsou prokázána, v souladu s P. řezem závisí pouze na velikosti a poměru hypotetických velkých a malých pórů ve stěnách cév. Za patologických podmínek lze dosáhnout efektu zvýšení endoteliální porozity v různých cestách: tvorba mezibuněčných kanálů, jako jsou histaminové mezery; zvýšený mikrovezikulární a intravakuolární transport; perforace endoteliálních buněk na základě zvýšené mikrovezikulace, vakuolizace nebo tvorby mikrobublin v endotelu; mikrofokální destrukce endoteliálních buněk; deskvamace endoteliálních buněk; změna fyzikálně-chem vlastnosti povrchu endoteliálních buněk atd. (viz Mikrocirkulace ]]). Stejného efektu lze dosáhnout i díky mimostěnovým mechanismům, zejména díky změnám vazebné kapacity krevních makromolekul, se kterými interagují téměř všechny známé indikátory používané k hodnocení stavu cévního P. U patologických stavů nejčastěji různé z nich působí současně nebo postupně uvedené mechanismy. Histamin tedy například zvyšuje poréznost cévní stěny jednak tvorbou histaminových mezer v endotelu venul, jednak ovlivňováním povrchu endotelových buněk a transportních procesů spojených s jeho aktivitou a ultrastrukturálními přeměnami (tvorba transcelulárního póry, fenestrae, mikrotubuly atd.). Je třeba vzít v úvahu, že v tomto případě se často mění tloušťka endoteliálních buněk a hloubka mezibuněčných mezer, což může mít významný vliv na propustnost cévní stěny jako difúzní bariéry. Otázka chování v podmínkách biochemické patologie nebyla vůbec studována. mechanismy, které brání nebo naopak usnadňují pronikání látek, zejména biologicky aktivních, cévní stěnou. Je například známo, že endoteliální buňky mozkových kapilár mají normálně enzymatickou aktivitu, která ničí serotonin a tím brání jeho pronikání z krve do mozku i v opačném směru. Endotel plicních kapilár obsahuje kininázu II, která je lokalizována v mikropinocytotických váčcích a zajišťuje destrukci bradykininu a zároveň konverzi angiotenzinu I na angiotenzin II (hypertenze). Endotel tak vykonává jakousi kontrolu nad rovnováhou humorálních bioregulátorů a aktivně ovlivňuje histohematický metabolismus těchto látek.
Cílená intervence se provádí na třech úrovních (viz schéma). První úroveň - vliv na proces tvorby příčinných (předepsaných) faktorů - se prakticky nepoužívá, i když existují určité léky, které mohou působit právě na této úrovni. Reserpin například ovlivňuje ukládání faktorů ovlivňujících P. v žírných buňkách, které jsou hlavním zdrojem mediátorů akutního zánětu (histamin a serotonin); antiprostaglandinové léky inhibují syntézu prostaglandinů - kyselina acetylsalicylová atd.
Druhá rovina je hlavní v praxi vývoje prostředků pro prevenci a léčbu cévních onemocnění, která odpovídá procesu přijímání vyvolávajícího faktoru. Významný počet antihistaminik, antiserotoninů a antibradykininů se používá k prevenci vaskulárních poruch P. způsobených odpovídajícími mediátory. Výhodou a zároveň nevýhodou těchto léků, které působí blokádou specifických receptorů, je jejich vysoká specificita. Tato specifičnost je činí neúčinnými v podmínkách multiplicity etiolu. faktory působící současně nebo postupně, což je obvykle pozorováno v klínu. praxe. Je také důležité, že vyloučení působení jednoho nebo více faktorů, které určují vývoj jedné fáze vaskulární poruchy P., nevylučuje vývoj fází následujících. Tyto nedostatky lze překonat zásahem třetí úrovně.
Třetí rovinou je ovlivnění intracelulárních (subcelulárních) efektorových mechanismů, jejichž prostřednictvím se přímo realizuje působení P. faktorů a jsou stejné pro působení různých patogenních agens. Reálnost a účinnost tohoto přístupu lze experimentálně demonstrovat použitím látky (cytochalasin-B), která inhibuje fenomén operační strukturalizace mikrofibrilárního aparátu v endoteliálních buňkách (tvorba aktinového gelu a aktinových mikrofibril).
V klínu. V praxi se k normalizaci zvýšeného vaskulárního P. používá vitamín P (viz Bioflavonoidy) a vápenaté soli. Tyto léky však nelze považovat za specifické pro léčbu. léky na vaskulární poruchy P., ačkoli mají regenerační účinek na histohematické bariéry, membrány a zejména cévní stěnu.
Ke zvýšení vaskulárního P. lze použít například různé endogenní P. faktory. histamin nebo látky, které je uvolňují z tkáňových zásob.
Bibliografie: Alekseev O. V. Mikrocirkulační homeostáza, v knize: Homeostáza, ed. P. D. Gorizontová, str. 278, M., 1976; Antonov V. F. Lipidy a iontová permeabilita membrán, M., 1982; Biologické membrány, ed. D. S. Parsons, přel. z angličtiny, M., 1978; D e Robert tis E., Novinský V. a S a e s F. Buněčná biologie, přel. z angličtiny, M., 1967; Živá buňka, přel. z angličtiny, ed. G. M. Frank, str. 130, M., 1962; K a z-nacheev V.P. a Dz i z i n s k i y A. A. Klinická patologie transkapilární výměny, M., 1975; Lehká noha E. Přenosové jevy v živých systémech, trans. z angličtiny, M., 1977; L a k sh m i n a r a i n a i a kh N. Membránové elektrody, trans. z angličtiny, L., 1979; Lev A. A. Modelování iontové selektivity buněčných membrán, L., 1976; Ovchinnikov Yu. A., Ivanov V. T. a III k r o b A. M. Membrane-active complexons, M., 1974; Struktura a funkce buňky, trans. z angličtiny, ed. G. M. Frank, str. 173, M., 1964; Troshin A. S. Problém buněčné permeability, M. - L., 1956; Chernukh A. M., Aleksandrov P. N. a Alekseev O. V. Microcirculation, M., 1975; Di Rosa M., Giroud J. R. a. W 1 1-loughby D. A. Studie mediátorů akutní zánětlivé reakce vyvolané u krys na různých místech karagenanem a terpentýnem, J. Path., v. 104, str. 15, 1971; M a j n o G. a. P a 1 a-de G. E. Studie o zánětech, I. Vliv histaminu a serotoninu na vaskulární permeabilitu, studie elektronového mikroskopu, J. biophys. biochem. Cytol., v. 11, str. 571, 1961; M a j n o G., S h e a S. M. a. Leventhal M. Endoteliální kontaktní reakce vyvolaná mediátory histaminového typu, J. Cell Biol., v. 42, str. 647, 1969: Shimamoto T. Kontrakce endoteliálních buněk jako klíčový mechanismus v aterogenezi a léčbě aterosklerózy pomocí relaxantů endoteliálních buněk, in: Atherosclerosis III, ed. od G. Schettlera a. A. Weizel, str. 64, V.-N. Y., 1974.
V. F. Antonov; O. V. Aleksejev (pat. fyzika).