Ester skupina. Estery v každodenním životě. Struktura esterové skupiny
Ethery (alkanoxidy) lze považovat za sloučeniny vzniklé nahrazením obou atomů vodíku molekuly vody dvěma alkylovými radikály nebo nahrazením hydroxylalkoholu alkylovým radikálem.
Isomerie a nomenklatura. Obecný vzorec etherů je ROR(I) ((C n H 2 n +1) 2 O) nebo C n H 2 n +1 OC k H 2 k +1, kde nk (R 1 OR 2) (II). Posledně jmenované se často nazývají směsné ethery, ačkoli (I) je zvláštní případ (II).
Ethery jsou izomery k alkoholům (izomerie funkčních skupin). Zde jsou příklady takových spojení:
H3C O CH3 dimethylether; C2H5OH ethylalkohol;
H5C2 O C2H5 diethylether; C4H9OH butylalkohol;
H5C2 O C3H7 ethylpropylether; C5H11OH amylalkohol.
Izomerie uhlíkového skeletu je navíc běžná pro ethery (methylpropylether a methylisopropylether). Opticky aktivních etherů je málo.
Způsoby přípravy etherů
1. Interakce halogenderivátů s alkoholáty (Williamsonova reakce).
C2H50Na+I C 2H 5 H 5 C 2 O C2H5+NaI
2. Dehydratace alkoholů v přítomnosti vodíkových iontů jako katalyzátorů.
2C2H5OHH5C2 O C2H5
3. Částečná reakce za vzniku diethyletheru.
P ![]() první etapa:
první etapa:
V ![]() Druhá fáze:
Druhá fáze:
Fyzikální vlastnosti etherů
První dva nejjednodušší zástupci – dimethyl a methylethylether – jsou za normálních podmínek plyny, všichni ostatní jsou kapaliny. Jejich bod varu je mnohem nižší než u odpovídajících alkoholů. Bod varu ethanolu je tedy 78,3C a H 3 COCH 3 je 24C, respektive (C 2 H 5) 2 O je 35,6 C. Faktem je, že ethery nejsou schopny tvořit molekulární vodíkové vazby a následně ani asociovat molekuly.
Chemické vlastnosti etherů
1. Interakce s kyselinami.
(C 2H 5) 2 O +HCl[(C 2H 5) 2OH + ]Cl .
Éter hraje roli báze.
2. Acidolýza – interakce se silnými kyselinami.
H5C2 O C 2H 5 + 2H 2 SO 4 2C 2 H 5 OSO 3 H
kyselina ethylsírová
H5C2 O C2H5+HIC2H5OH+ C2H5I
3. Interakce s alkalickými kovy.
H5C2 O C 2 H 5 + 2NaC 2H 5 ONa+ C 2H 5 Na
Jednotliví zástupci
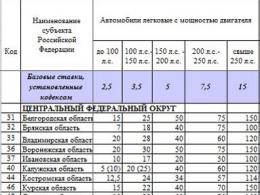
Ethylether (diethylether) je bezbarvá průhledná kapalina, mírně rozpustná ve vodě. Smíchá se s ethylalkoholem v libovolném poměru. T pl =116,3С, tlak nasycených par 2,6610 4 Pa (2,2С) a 5,3210 4 Pa (17,9С). Kryoskopická konstanta je 1,79, ebulioskopická konstanta je 1,84. Teplota vznícení je 9,4С, tvoří se vzduchem výbušnou směs o 1,71 obj. % (spodní hranice) – 48,0 obj. % (horní limit). Způsobuje bobtnání gumy. Široce používané jako rozpouštědlo, v lékařství (inhalační anestezie), návykové pro člověka, jedovaté.
Estery karboxylových kyselin Příprava esterů karboxylových kyselin
1. Esterifikace kyselin alkoholy.
![]()
Hydroxylová kyselina se uvolňuje ve vodě, zatímco alkohol uvolňuje pouze atom vodíku. Reakce je reverzibilní, reverzní reakci katalyzují stejné kationty.
2![]() . Interakce anhydridů kyselin s alkoholy.
. Interakce anhydridů kyselin s alkoholy.
3. Interakce halogenidů kyselin s alkoholy.
![]()
Některé fyzikální vlastnosti esterů jsou uvedeny v tabulce 12.
Tabulka 12
Některé fyzikální vlastnosti řady esterů
|
Radikální struktura |
název |
Hustota
|
|||
|
methylformiát | |||||
|
ethylformiát | |||||
|
methylacetát | |||||
|
ethylacetát | |||||
|
n-propylacetát | |||||
|
n-butylacetát |
Estery nižších karboxylových kyselin a jednoduché alkoholy jsou kapaliny s osvěžující ovocnou vůní. Používá se jako ochucovadla pro přípravu nápojů. Mnoho etherů (ethylacetát, butylacetát) se široce používá jako rozpouštědla, zejména pro laky.
10.5. Estery. Tuky
Estery– funkční deriváty karboxylových kyselin,
v molekulách, ve kterých je hydroxylová skupina (-OH) nahrazena alkoholovým zbytkem (- NEBO)
Estery karboxylových kyselin – sloučeniny obecného vzorce.
R-COOR", kde R a R" jsou uhlovodíkové radikály.
Estery nasycených jednosytných karboxylových kyselin mít obecný vzorec:

Fyzikální vlastnosti:
· Těkavé, bezbarvé kapaliny
· Špatně rozpustný ve vodě
· Nejčastěji s příjemnou vůní
Lehčí než voda
Estery se nacházejí v květech, ovoci a bobulích. Určují jejich specifickou vůni.
Jsou nedílnou součástí éterické oleje(je známo asi 3000 e.m. - pomeranč, levandule, růže atd.)
Estery nižších karboxylových kyselin a nižších jednosytných alkoholů příjemně voní po květinách, bobulích a ovoci. Základem přírodních vosků jsou estery vyšších jednosytných kyselin a vyšších jednosytných alkoholů. Například včelí vosk obsahuje ester kyseliny palmitové a myricylalkohol (myricylpalmitát):
CH 3 (CH 2) 14 –CO–O– (CH 2) 29 CH 3
Aroma. Strukturní vzorec. |
Jméno Ester |
Jablko
|
Ethylether kyselina 2-methylbutanová |
Třešeň
|
Amylester kyseliny mravenčí |
Hruška
|
Isoamylester kyseliny octové |
Ananas |
Ethylester kyseliny máselné (ethyl butyrát) |
Banán |
Isobutylester kyseliny octové (isoamyl acetát má také banánovou vůni) |
Jasmín
|
Benzyletheracetát (benzylacetát) |
Krátké názvy esterů jsou založeny na názvu radikálu (R") v alkoholovém zbytku a názvu skupiny RCOO ve zbytku kyseliny. Například kyselina octová CH3COOC2H5 volal ethylacetát.

aplikace
· Jako vůně a zvýrazňovače zápachu v potravinářském a parfumérském průmyslu (výroba mýdla, parfémů, krémů);
· Při výrobě plastů a pryže jako změkčovadla.

Plastifikátory – látky, které se zavádějí do kompozice polymerních materiálů, aby udělily (nebo zvýšily) elasticitu a (nebo) plasticitu během zpracování a provozu.
Aplikace v lékařství
Na konci 19. a začátku 20. století, kdy organická syntéza dělala své první kroky, bylo syntetizováno a testováno farmakology mnoho esterů. Staly se základem takových léky jako salol, validol atd. Jako lokální dráždidlo a analgetikum byl široce používán methylsalicylát, který je dnes prakticky nahrazen účinnějšími látkami.
Příprava esterů
Estery lze získat reakcí karboxylových kyselin s alkoholy ( esterifikační reakce). Katalyzátory jsou minerální kyseliny.
Esterifikační reakce za kyselé katalýzy je reverzibilní. Opačný proces – štěpení esteru působením vody za vzniku karboxylové kyseliny a alkoholu – se nazývá tzv. hydrolýza esteru.
RCOOR" + H2O ( H +) ↔ RCOOH + R "OH
Hydrolýza v přítomnosti alkálie je nevratná (protože výsledný záporně nabitý karboxylátový anion RCOO nereaguje s nukleofilním činidlem - alkoholem).
Tato reakce se nazývá zmýdelnění esterů(analogicky s alkalickou hydrolýzou esterových vazeb v tucích při výrobě mýdla).
Tuky, jejich struktura, vlastnosti a použití
„Chemie je všude, chemie je ve všem:
Ve všem, co dýcháme
Ve všem, co pijeme
Ve všem, co jíme."
Ve všem, co nosíme



Lidé se odedávna naučili extrahovat tuk z přírodních předmětů a používat ho v každodenním životě. Tuk se spaloval v primitivních lampách, osvětlujících jeskyně primitivních lidí; běhouny, na kterých byly spuštěny lodě, byly mazány tukem. Tuky jsou hlavním zdrojem naší výživy. Ale špatná výživa a sedavý způsob života vedou k nadváze. Pouštní živočichové ukládají tuk jako zdroj energie a vody. Silná tuková vrstva tuleňů a velryb jim pomáhá plavat ve studených vodách Severního ledového oceánu.
Tuky jsou v přírodě široce rozšířeny. Spolu se sacharidy a bílkovinami jsou součástí všech živočišných a rostlinných organismů a tvoří jednu z hlavních součástí naší potravy. Zdrojem tuků jsou živé organismy. Mezi zvířata patří krávy, prasata, ovce, slepice, tuleni, velryby, husy, ryby (žraloci, tresky, sledě). Získává se z tresčích a žraločích jater rybí tuk– léky, ze sledě – tuky používané ke krmení hospodářských zvířat. Rostlinné tuky jsou nejčastěji tekuté a nazývají se oleje. Používají se tuky z rostlin jako je bavlna, len, sója, arašídy, sezam, řepka, slunečnice, hořčice, kukuřice, mák, konopí, kokos, rakytník, šípky, palma olejná a mnoho dalších.

Tuky plní různé funkce: stavební, energetické (1 g tuku poskytuje 9 kcal energie), ochranné, zásobní. Tuky poskytují 50 % energie potřebné pro člověka, takže člověk potřebuje zkonzumovat 70–80 gramů tuku denně. Tuky tvoří 10–20 % tělesné hmotnosti zdravý člověk. Tuky jsou nezbytným zdrojem mastných kyselin. Některé tuky obsahují vitamíny A, D, E, K a hormony.
Mnoho zvířat a lidí používá tuk jako tepelně izolační skořápku, například u některých mořských živočichů dosahuje tloušťka tukové vrstvy metr. Kromě toho jsou tuky rozpouštědly pro ochucovadla a barviva v těle. Mnoho vitamínů, jako je vitamín A, je rozpustných pouze v tucích.
Některá zvířata (obvykle vodní ptactvo) používají tuky k mazání vlastních svalových vláken.
Tuky zvyšují sytící účinek potravin, protože se tráví velmi pomalu a oddalují nástup hladu. .
Historie objevu tuků
Zpátky v 17. století. Německý vědec, jeden z prvních analytických chemiků Otto Tacheny(1652–1699) poprvé navrhl, že tuky obsahují „skrytou kyselinu“.
V roce 1741 francouzský chemik Claude Joseph Geoffroy(1685–1752) zjistil, že když se mýdlo (které se připravovalo vařením tuku s alkálií) rozkládá kyselinou, vzniká hmota, která je na dotek mastná.
To, že tuky a oleje obsahují glycerin, poprvé objevil v roce 1779 slavný švédský chemik Karl Wilhelm Scheele.
Chemické složení tuků poprvé určil francouzský chemik na začátku minulého století. Michel Eugene Chevreul, zakladatel chemie tuků, autor četných studií o jejich povaze, shrnutých v šestidílné monografii „Chemical Studies of Body of Animal Origin“.
1813 E. Chevreul stanovil strukturu tuků díky hydrolytické reakci tuků v alkalickém prostředí.Ukázal, že tuky se skládají z glycerolu a mastných kyselin, a to není jen jejich směs, ale sloučenina, která přidáním vody rozkládá na glycerol a kyseliny.
Syntéza tuku

V roce 1854 provedl francouzský chemik Marcelin Berthelot (1827–1907) esterifikační reakci, tedy vznik esteru mezi glycerolem a mastnými kyselinami, a poprvé tak syntetizoval tuk.

Obecný vzorec tuků (triglyceridů)

Tuky
– estery glycerolu a vyšších karboxylových kyselin.
Společný název pro tyto sloučeniny je triglyceridy.
Klasifikace tuků



Živočišné tuky obsahují hlavně glyceridy nasycených kyselin a jsou pevné. Rostlinné tuky, často nazývané oleje, obsahují glyceridy nenasycených karboxylových kyselin. Jsou to například tekuté slunečnicové, konopné a lněné oleje.

Přírodní tuky obsahují následující mastné kyseliny
Nasycený: stearová (C 17 H 35 COOH) palmitová (C 15 H 31 COOH) Olejový (C 3 H 7 COOH) |
OBSAHUJÍCÍ ZVÍŘATA TUKY |
Nenasycené : olejová (C17H33COOH, 1 dvojná vazba) linolová (C 17 H 31 COOH, 2 dvojné vazby) linolenová (C 17 H 29 COOH, 3 dvojné vazby) arachidonová (C 19 H 31 COOH, 4 dvojné vazby, méně časté) |
OBSAHUJÍCÍ ROSTLINA TUKY |
Tuky se nacházejí ve všech rostlinách a zvířatech. Jsou to směsi plných glycerolesterů a nemají jasně definovanou teplotu tání.
· Živočišné tuky(jehněčí, vepřové, hovězí atd.) jsou zpravidla pevné látky s nízkým bodem tání (výjimkou je rybí tuk). V pevných tucích převažují zbytky nasycený kyseliny
· Rostlinné tuky – oleje (slunečnicový, sójový, bavlníkový atd.) – tekutiny (výjimka – kokosový olej, máslo z kakaových bobů). Oleje obsahují především zbytky nenasycený (nenasycený) kyseliny
Chemické vlastnosti Tlustý
1. Hydrolýza, nebo zmýdelnění , Tlustý dochází pod vlivem vody, za účasti enzymů nebo kyselých katalyzátorů (reverzibilní), v tomto případě vzniká alkohol - glycerin a směs karboxylových kyselin:

nebo alkálie (nevratné). Alkalickou hydrolýzou vznikají soli vyšších mastných kyselin, zvané mýdla. Mýdla se získávají hydrolýzou tuků v přítomnosti alkálií:

Mýdla jsou draselné a sodné soli vyšších karboxylových kyselin.
2. Hydrogenace tuků – přeměna kapaliny rostlinné oleje v pevných tucích – má velká důležitost pro potravinářské účely. Produktem hydrogenace oleje je tuhý tuk (umělé sádlo, salomas). Margarín– jedlý tuk, skládá se ze směsi hydrogenovaných olejů (slunečnicový, kukuřičný, bavlníkový atd.), živočišných tuků, mléka a aromatických přísad (sůl, cukr, vitamíny atd.).
Takto se vyrábí margarín v průmyslu:

Za podmínek procesu hydrogenace oleje (vysoká teplota, kovový katalyzátor) jsou některé kyselé zbytky obsahující vazby cis C=C izomerizovány na stabilnější trans izomery. Zvýšený obsah zbytků trans-nenasycených kyselin v margarínech (zejména u levných odrůd) zvyšuje riziko aterosklerózy, kardiovaskulárních a dalších onemocnění.

Reakce tvorby tuku (esterifikace)

Aplikace tuků


Tuky jsou potravinářský výrobek. Biologická role tuků
Živočišné tuky a rostlinné oleje jsou spolu s bílkovinami a sacharidy jednou z hlavních složek normální lidské výživy. Jsou hlavním zdrojem energie: 1 g tuku při plné oxidaci (vyskytuje se v buňkách za účasti kyslíku) poskytuje 9,5 kcal (asi 40 kJ) energie, což je téměř dvojnásobek toho, co lze získat z bílkoviny nebo sacharidy. Tukové zásoby v těle navíc neobsahují prakticky žádnou vodu, zatímco molekuly bílkovin a sacharidů jsou vždy obklopeny molekulami vody. Výsledkem je, že jeden gram tuku poskytuje téměř 6x více energie než jeden gram živočišného škrobu – glykogenu. Tuk by tedy měl být právem považován za vysoce kalorické „palivo“. Vynakládá se především na udržení normální teploty lidského těla a také na práci různých svalů, takže i když člověk nic nedělá (například spí), potřebuje každou hodinu asi 350 kJ energie na pokrytí energetických nákladů. , přibližně stejný výkon jako elektrická 100wattová žárovka.
Pro zásobování těla energií v nepříznivých podmínkách se v něm vytvářejí tukové zásoby, které se ukládají v podkoží, v tukovém záhybu pobřišnice - tzv. omentum. Podkožní tuk chrání tělo před podchlazením (tato funkce tuků je důležitá zejména pro mořské živočichy). Po tisíce let lidé vykonávali těžké výkony fyzická práce, což vyžadovalo velké množství energie a v důsledku toho zvýšenou výživu. K pokrytí minima denní potřebaČlověk potřebuje na energii pouze 50 g tuku. Nicméně s mírným fyzická aktivita dospělý člověk by měl přijímat o něco více tuků z potravy, ale jejich množství by nemělo přesáhnout 100 g (to poskytuje třetinový obsah kalorií při dietě asi 3000 kcal). Nutno podotknout, že polovinu z těchto 100 g obsahují potraviny ve formě tzv. skrytého tuku. Tuky jsou obsaženy téměř ve všech potravinářských výrobcích: v malém množství jsou dokonce v bramborách (tam 0,4 %), v pečivu (1–2 %) a v ovesných vločkách (6 %). Mléko obvykle obsahuje 2-3 % tuku (ale existují i speciální druhy odstředěného mléka). Docela hodně skrytého tuku libové maso– od 2 do 33 %. Skrytý tuk je v produktu přítomen ve formě jednotlivých drobných částeček. Téměř čisté tuky jsou sádlo a rostlinný olej; PROTI máslo asi 80% tuku, v taveném - 98%. Všechna uvedená doporučení pro konzumaci tuků jsou samozřejmě průměrná, závisí na pohlaví a věku, fyzické aktivitě a klimatických podmínkách. Při nadměrné konzumaci tuků člověk rychle přibírá na váze, ale neměli bychom zapomínat, že tuky v těle lze syntetizovat i z jiných potravin. „Odpracovat“ kalorie navíc fyzickou aktivitou není tak snadné. Například po uběhnutí 7 km člověk vydá přibližně stejné množství energie, jaké získá snědením pouhých sto gramů čokoládové tyčinky (35 % tuku, 55 % sacharidů). Fyziologové zjistili, že při fyzické aktivitě, která je 10krát vyšší než obvykle byla osoba, která dostávala tukovou dietu, po 1,5 hodině zcela vyčerpaná. Při sacharidové dietě člověk vydržel stejnou zátěž 4 hodiny. Tento zdánlivě paradoxní výsledek se vysvětluje zvláštnostmi biochemických procesů. Přes vysokou „energetickou náročnost“ tuků je získávání energie z nich v těle pomalý proces. To je způsobeno nízkou reaktivitou tuků, zejména jejich uhlovodíkových řetězců. Sacharidy, ačkoli poskytují méně energie než tuky, ji „uvolňují“ mnohem rychleji. Před fyzickou aktivitou je proto vhodnější jíst sladkosti než tučná jídla.Přebytek tuků v potravě, zejména živočišných, zvyšuje riziko vzniku onemocnění jako je ateroskleróza, srdeční selhání apod. Živočišné tuky obsahují hodně cholesterolu ( ale neměli bychom zapomínat, že dvě třetiny cholesterolu se v těle syntetizují z nízkotučných potravin – sacharidů a bílkovin).
Je známo, že významný podíl konzumovaného tuku by měly tvořit rostlinné oleje, které obsahují pro tělo velmi důležité sloučeniny – polynenasycené mastné kyseliny s několika dvojnými vazbami. Tyto kyseliny se nazývají „esenciální“. Stejně jako vitamíny se musí do těla dostat v hotové formě. Z nich má největší aktivitu kyselina arachidonová (je syntetizována v těle z kyseliny linolové), nejmenší aktivitu má kyselina linolenová (10x nižší než kyselina linolová). Podle různých odhadů se denní potřeba kyseliny linolové pohybuje od 4 do 10 g. Nejvyšší množství kyseliny linolové (až 84 %) je ve světlicovém oleji, vymačkaném ze semen světlice barvířské, jednoleté rostliny s jasně oranžovými květy . Hodně této kyseliny je také ve slunečnicových a ořechových olejích.
Vyvážená strava by podle odborníků na výživu měla obsahovat 10 % polynenasycených kyselin, 60 % mononenasycených kyselin (hlavně kyseliny olejové) a 30 % nasycených kyselin. To je poměr, který je zajištěn, pokud člověk přijímá třetinu tuků ve formě tekutých rostlinných olejů – v množství 30–35 g denně. Tyto oleje jsou také obsaženy v margarínu, který obsahuje od 15 do 22 % nasycených mastných kyselin, od 27 do 49 % nenasycených a od 30 do 54 % polynenasycených. Pro srovnání: máslo obsahuje 45–50 % nasycených mastných kyselin, 22–27 % nenasycených a méně než 1 % polynenasycených. V tomto ohledu je kvalitní margarín zdravější než máslo.
Nutno pamatovat!!!
Nasycené mastné kyseliny negativně ovlivňují metabolismus tuků, funkci jater a přispívají k rozvoji aterosklerózy. Nenasycené kyseliny (zejména kyselina linolová a arachidonová) regulují metabolismus tuků a podílejí se na odstraňování cholesterolu z těla. Čím vyšší je obsah nenasycených mastných kyselin, tím nižší je bod tání tuku. Kalorický obsah pevných živočišných tuků a tekutých rostlinných tuků je přibližně stejný, ale fyziologická hodnota rostlinných tuků je mnohem vyšší. Mléčný tuk má cennější vlastnosti. Obsahuje třetinu nenasycených mastných kyselin a konzervovaný ve formě emulze je tělem snadno vstřebatelný. Navzdory těmto pozitivní vlastnosti, nemůžete konzumovat pouze mléčný tuk, protože neobsahuje žádný tuk ideální složení mastné kyseliny. Nejlepší je konzumovat tuky živočišného i rostlinného původu. Jejich poměr by měl být 1:2,3 (70 % živočišných a 30 % rostlinných) pro mladé lidi a lidi středního věku. Ve stravě starších lidí by měly převažovat rostlinné tuky.
Tuky se nejen účastní metabolických procesů, ale jsou také ukládány do rezervy (hlavně v břišní stěně a v okolí ledvin). Tukové zásoby zajišťují metabolické procesy, uchovávají bílkoviny po celý život. Tento tuk dodává energii při fyzické aktivitě, pokud je tuků dodáváno v potravě málo, dále při těžkých onemocněních, kdy z důvodu snížené chuti k jídlu není dostatečně zásobován potravou.
Nadměrná konzumace tuku v potravinách je zdraví škodlivá: ukládá se ve velkém množství do rezervy, což zvyšuje tělesnou hmotnost, někdy vede k znetvoření postavy. Zvyšuje se jeho koncentrace v krvi, což jako rizikový faktor přispívá k rozvoji aterosklerózy, ischemické choroby srdeční, hypertenze atd.
CVIČENÍ
1. Existuje 148 g směsi dvou organických sloučenin stejného složení: C 3 H 6 O 2. Určete strukturu těchto sójových bobů dyenia a jejich hmotnostní zlomky ve směsi, pokud je známo, že jeden z při interakci s přebytkem hydrogenuhličitanu sodného uvolňují 22,4 l (n.s.) oxidu uhelnatého ( IV), a druhý nereaguje s roztokem uhličitanu sodného a amoniaku oxidu stříbrného, ale při zahřívání s vodným roztokem hydroxidu sodného tvoří alkohol a sůl kyseliny.
Řešení:
Je známo, že oxid uhelnatý ( IV ) se uvolňuje, když uhličitan sodný reaguje s kyselinou. Může být pouze jedna kyselina o složení C 3 H 6 O 2 - propionová, CH 3 CH 2 COOH.
C 2H 5 COOH + N aHCO 3 → C 2H 5 COONa + CO 2 + H20.
Dle podmínky se uvolnilo 22,4 litrů CO 2, což je 1 mol, což znamená, že ve směsi byl i 1 mol kyseliny. Molární hmotnost výchozích látek organické sloučeniny je rovný: M (C 3 H 6 O 2) = 74 g/mol, tedy 148 g jsou 2 mol.
Druhá sloučenina po hydrolýze tvoří alkohol a sůl kyseliny, což znamená, že jde o ester:
RCOOR + NaOH → RCOONa + R‘OH.
Složení C 3 H 6 O 2 odpovídá dvěma esterům: ethylformiátu HCOOC 2 H 5 a methylacetátu CH 3 COOCH 3. Estery kyseliny mravenčí reagují s roztokem amoniaku oxidu stříbrného, takže první ester nesplňuje podmínky problému. Proto je druhou látkou ve směsi methylacetát.
Protože směs obsahovala jeden mol sloučenin se stejnou molární hmotností, jsou jejich hmotnostní zlomky stejné a činí 50 %.
Odpovědět. 50 % CH3CH2COOH, 50 % CH3COOCH 3.
2. Relativní hustota par esteru vzhledem k vodíku je 44. Při hydrolýze tohoto esteru vznikají dvě sloučeniny, z nichž při spalování stejných množství vznikají stejné objemy oxidu uhličitého (za stejných podmínek). strukturní vzorec tohoto esteru.
Řešení:
Obecný vzorec esterů tvořených nasycenými alkoholy a kyselinami je C n N 2 n O 2 Hodnotu n lze určit z hustoty vodíku:
M (CnH2n02) = 14 n + 32 = 44. 2 = 88 g/mol,
odkud n = 4, to znamená, že ether obsahuje 4 atomy uhlíku. Protože při spalování alkoholu a kyseliny vzniklé během hydrolýzy etheru se uvolňují stejné objemy oxidu uhličitého, obsahuje kyselina a alkohol stejný počet atomů uhlíku, každý po dvou. Požadovaný ester je tedy tvořen kyselinou octovou a ethanolem a nazývá se ethylacetát:
CH 3 - |
O-S2N5 |
Odpovědět. Ethylacetát, CH3SOOC2H5.
________________________________________________________________
3. Při hydrolýze esteru, jehož molární hmotnost je 130 g/mol, vzniká kyselina A a alkohol B. Určete strukturu esteru, je-li známo, že stříbrná sůl kyseliny obsahuje 59,66 % stříbra o Hmotnost. Alkohol B není oxidován dichromanem sodným a snadno reaguje s kyselinou chlorovodíkovou za vzniku alkylchloridu.
Řešení:
Ester má obecný vzorec RCOOR ‘. Je známo, že stříbrná sůl kyseliny, RCOOAg , obsahuje 59,66 % stříbra, proto je molární hmotnost soli: M (RCOOAg) = M (A g )/0,5966 = 181 g/mol, odkud PAN ) = 181-(12+2,16+108) = 29 g/mol. Tento radikál je ethyl, C2H5, a ester byl vytvořen kyselinou propionovou: C2H5COOR'.
Molární hmotnost druhého radikálu je: M (R') = M (C2H5COOR ') - M(C2H5COO) = 130-73 = 57 g/mol. Tento radikál má molekulární vzorec C4H9. Alkohol C 4 H 9 OH podle stavu neoxiduje Na 2 C r 2 O 7 a snadno s ním reaguje HCl proto je tento alkohol terciární, (CH 3) 3 SON.
Požadovaný ester je tedy tvořen kyselinou propionovou a terc-butanolem a nazývá se terc-butylpropionát:
CH 3 |
||
C 2 H 5 - |
C-O- |
C - CH 3 |
CH 3 |
Odpovědět . terc-butyl propionát.
________________________________________________________________
4. Napište dva možné vzorce pro tuk, který má v molekule 57 atomů uhlíku a reaguje s jódem v poměru 1:2. Tuk obsahuje zbytky kyselin se sudým počtem atomů uhlíku.
Řešení:
Obecný vzorec tuků:
kde R, R', R " - uhlovodíkové radikály obsahující lichý počet atomů uhlíku (další atom z kyselého zbytku je součástí skupiny -CO-). Na tři uhlovodíkové radikály připadá 57-6 = 51 atomů uhlíku. Lze předpokládat, že každý z radikálů obsahuje 17 atomů uhlíku.
Protože jedna molekula tuku může připojit dvě molekuly jódu, na tři radikály připadají dvě dvojné vazby nebo jedna trojná vazba. Pokud jsou v jednom radikálu dvě dvojné vazby, pak tuk obsahuje zbytek kyseliny linolové ( R = C17H31) a dva zbytky kyseliny stearové ( R' = R " = C 17 H 35). Pokud jsou dvě dvojné vazby v různých radikálech, pak tuk obsahuje dva zbytky kyseliny olejové ( R = R' = C17H33 ) a zbytek kyseliny stearové ( R " = C 17 H 35). Možné vzorce tuku:
|
|
________________________________________________________________


5.

ÚKOLY PRO SAMOSTATNÉ ŘEŠENÍ
1. Co je to esterifikační reakce?
2. Jaký je rozdíl ve struktuře pevných a tekutých tuků?
3. Jaké jsou chemické vlastnosti tuků?
4. Uveďte reakční rovnici pro výrobu methylformiátu.
5. Napsat strukturní vzorce dva estery a kyselinu o složení C3H602. Pojmenujte tyto látky podle mezinárodní nomenklatury.
6. Napište rovnice pro esterifikační reakce mezi: a) kyselinou octovou a 3-methylbutanolem-1; b) kyselina máselná a propanol-1. Pojmenujte étery.
7. Kolik gramů tuku bylo odebráno, kdyby bylo zapotřebí 13,44 litrů vodíku (N.S.) k hydrogenaci kyseliny vzniklé v důsledku jeho hydrolýzy?
8. Vypočítejte hmotnostní zlomek výtěžku esteru vzniklého při zahřívání 32 g kyseliny octové a 50 g 2-propanolu v přítomnosti koncentrované kyseliny sírové, pokud vznikne 24 g esteru.
9. K hydrolýze vzorku tuku o hmotnosti 221 g bylo zapotřebí 150 g roztoku hydroxidu sodného s alkalickým hmotnostním zlomkem 0,2. Navrhněte strukturní vzorec původního tuku.
10. Vypočítejte objem roztoku hydroxidu draselného s hmotnostním zlomkem alkálie 0,25 a hustotou 1,23 g/cm 3, který musí být spotřebován k provedení hydrolýzy 15 g směsi sestávající z ethylesteru kyseliny ethanové, kyseliny methanové propylester a methylester kyseliny propanové.
VIDEO ZÁŽITEK
1. Jaká reakce je základem produkce esterů: |
|
a) neutralizace |
b) polymerace |
c) esterifikace |
d) hydrogenace |
2. Kolik izomerních esterů odpovídá vzorci C4H8O2: |
|
a) 2 |
|
Je však třeba poznamenat, že jejich použití má obrovský pozitivní vliv na lidský organismus a je nezbytné ke konzumaci stejně jako sacharidy a bílkoviny.
Co jsou tyto estery?
Estery nebo estery, jak se jim také říká, jsou deriváty oxokyselin (uhlíků i anorganických sloučenin), které mají obecný vzorec, a ve skutečnosti jsou to produkty, které zaměňují atomy vodíku hydroxylů - OH s kyselou funkcí za uhlovodíkový zbytek (alifatický, alkenylový, aromatický nebo heteroaromatický), jsou také považovány za acylové deriváty alkoholů.
Nejběžnější estery a oblasti jejich použití
- Acetáty jsou estery kyseliny octové, které se používají jako rozpouštědla.
- Laktáty jsou kyseliny mléčné a mají organické využití.
- Butyráty jsou olejové a mají také organické využití.
- Formiáty jsou kyselina mravenčí, ale vzhledem k jejich vysoké toxinové kapacitě se zvláště nepoužívají.
- Za zmínku stojí také rozpouštědla na bázi isobutylalkoholu, dále syntetické mastné kyseliny a alkylenkarbonáty.
- Methyl acetát - vyrábí se jako dřevný lihový roztok. Při výrobě polyvinylalkoholu vzniká jako doplňkový produkt. Díky své schopnosti rozpouštění se používá jako náhrada acetonu, má však vyšší toxické vlastnosti.
- Ethylacetát - tento ester vzniká esterifikační metodou v lesních chemických závodech při zpracování syntetické a lesní chemické kyseliny octové. Seženete i ethylacetát na bázi metylalkoholu. Ethylacetát má schopnost rozpouštět většinu polymerů, jako je aceton. V případě potřeby si můžete v Kazachstánu zakoupit Ethyl Acetate. Jeho schopnosti jsou skvělé. Jeho výhodou oproti acetonu je tedy to, že má poměrně vysoký bod varu a nižší těkavost. Vyplatí se přidat 15-20% ethylalkoholu a zvyšuje se schopnost rozpouštění.
- Propylacetát má podobné rozpouštěcí vlastnosti jako ethylacetát.
- Amylacetát – jeho aroma připomíná vůni banánového oleje. Oblast použití - rozpouštědlo laku, protože se pomalu rozpouští.
- Estery s ovocným aroma.
- Vinylacetát - aplikace zahrnují přípravu lepidel, barev a pryskyřic.
- Sodné a draselné soli tvoří mýdla.
Po prozkoumání a prostudování výhod a rozsahu použití esterů jste pochopili, že jsou v lidském životě obrovskou nutností. Přispívat k rozvoji v mnoha oblastech činnosti.
třída sloučenin na bázi minerálních (anorganických) nebo organických karboxylových kyselin, ve kterých je atom vodíku ve skupině HO nahrazen organickou skupinou R . Přídavné jméno „komplex“ v názvu esterů je pomáhá odlišit od sloučenin nazývaných ethery.Pokud je výchozí kyselina vícesytná, potom je možná tvorba buď úplných esterů, všechny HO skupiny, nebo částečná substituce esterů kyselin. U jednosytných kyselin jsou možné pouze plné estery (obr. 1).
Rýže. 1. PŘÍKLADY ESTERŮ na bázi anorganické a karboxylové kyseliny
Názvosloví esterů. Název se vytvoří následovně: nejprve je uvedena skupina R , připojené ke kyselině, pak název kyseliny s příponou „at“ (jako v názvech anorganických solí: uhlík na dusičnan sodný na chrom). Příklady na Obr.2
Pokud používáte triviální ( cm. TRIVIÁLNÍ NÁZVY LÁTEK) je název výchozí kyseliny, pak název sloučeniny zahrnuje slovo „ester“, například C 3 H 7 COOC 5 H 11 amylester kyseliny máselné.
Klasifikace a složení esterů. Mezi studovanými a široce používanými estery tvoří většinu sloučeniny odvozené od karboxylových kyselin. Estery na bázi minerálních (anorganických) kyselin nejsou tak rozmanité, protože třída minerálních kyselin je méně početná než karboxylové kyseliny (rozmanitost sloučenin je jednou z charakteristické rysy organická chemie).Když počet atomů C v původní karboxylové kyselině a alkoholu nepřesáhne 68, jsou odpovídajícími estery bezbarvé olejovité kapaliny, nejčastěji s ovocnou vůní. Tvoří skupinu ovocných esterů. Pokud se na tvorbě esteru podílí aromatický alkohol (obsahující aromatické jádro), pak takové sloučeniny zpravidla mají spíše květinovou než ovocnou vůni. Všechny sloučeniny této skupiny jsou prakticky nerozpustné ve vodě, ale snadno rozpustné ve většině organických rozpouštědel. Tyto sloučeniny jsou zajímavé pro svou širokou škálu příjemných vůní (tabulka 1), některé z nich byly nejprve izolovány z rostlin a později uměle syntetizovány.
| Stůl 1. NĚKTERÉ ESTERY, mající ovocné nebo květinové aroma (fragmenty původních alkoholů ve složení směsi a v názvu jsou zvýrazněny tučně) | ||
| Formule Ester | název | Aroma |
| CH 3 COO C4H9 | Butyl acetát | hruška |
| C3H7COO CH 3 | Methyl Ester kyseliny máselné | jablko |
| C3H7COO C2H5 | Ethyl Ester kyseliny máselné | ananas |
| C4H9COO C2H5 | Ethyl | karmínový |
| C4H9COO C5H11 | Isoamil ester kyseliny izovalerové | banán |
| CH 3 COO CH2C6H5 | Benzyl acetát | jasmín |
| C6H5COO CH2C6H5 | Benzyl benzoát | květinový |
Třetí skupinou jsou tuky. Na rozdíl od předchozích dvou skupin na bázi jednosytných alkoholů
ROH , všechny tuky jsou estery glycerolalkoholu HOCH 2 CH(OH)CH 2 OH. Karboxylové kyseliny, které tvoří tuky, mají obvykle uhlovodíkový řetězec s 919 atomy uhlíku. Živočišné tuky (kravské máslo, jehněčí, sádlo) plastické látky s nízkou teplotou tání. Rostlinné tuky (olivový, bavlníkový, slunečnicový olej) viskózní kapaliny. Živočišné tuky se skládají převážně ze směsi glyceridů kyseliny stearové a palmitové (obr. 3A, B). Rostlinné oleje obsahují glyceridy kyselin s o něco kratší délkou uhlíkového řetězce: laurovou C 11 H 23 COOH a myristickou C 13 H 27 COOH. (stejně jako stearová a palmitová jsou to nasycené kyseliny). Takové oleje mohou být skladovány na vzduchu po dlouhou dobu, aniž by se změnila jejich konzistence, a proto se nazývají nevysychající. Naproti tomu lněný olej obsahuje glycerid nenasycené kyseliny linolové (obrázek 3B). Při aplikaci v tenké vrstvě na povrch takový olej vlivem vzdušného kyslíku při polymeraci podél dvojných vazeb zasychá a vytváří se elastický film, který je nerozpustný ve vodě a organických rozpouštědlech. Přírodní vysoušecí olej se vyrábí ze lněného oleje.
Rýže. 3. GLYCERIDY KYSELINY STEAROVÉ A PALMITOVÉ (A A B) složky živočišného tuku. Glycerid kyseliny linolové (B) složka lněného oleje.
Estery minerálních kyselin (alkylsulfáty, alkylboritany obsahující fragmenty nižších alkoholů C 18) olejové kapaliny, estery vyšších alkoholů (počínaje C 9) pevné sloučeniny.
Chemické vlastnosti esterů. Nejcharakterističtější pro estery karboxylových kyselin je hydrolytické (pod vlivem vody) štěpení esterové vazby, v neutrálním prostředí probíhá pomalu a za přítomnosti kyselin nebo zásad se znatelně zrychluje, protože H+ a HO ionty tento proces katalyzují (obr. 4A), přičemž hydroxylové ionty působí efektivněji. Hydrolýza v přítomnosti alkálií se nazývá saponifikace. Pokud přijmete množství alkálie dostatečné k neutralizaci veškeré vzniklé kyseliny, dojde k úplnému zmýdelnění esteru. Tento proces se provádí v průmyslovém měřítku a glycerin a vyšší karboxylové kyseliny (C 1519) se získávají ve formě solí alkalických kovů, což jsou mýdlo (obr. 4B). Fragmenty nenasycených kyselin obsažené v rostlinných olejích, stejně jako jakékoli nenasycené sloučeniny, mohou být hydrogenovány, vodík se váže na dvojné vazby a vznikají sloučeniny podobné živočišným tukům (obr. 4B). Touto metodou se průmyslové tuky vyrábějí na bázi slunečnicového, sójového nebo kukuřičného oleje. Margarín se vyrábí z hydrogenačních produktů rostlinných olejů smíchaných s přírodními živočišnými tuky a různými potravinářskými přísadami.Hlavní metodou syntézy je interakce karboxylové kyseliny a alkoholu, katalyzovaná kyselinou a doprovázená uvolňováním vody. Tato reakce je opačná než reakce znázorněná na obr. 3A. Aby se proces ubíral správným směrem (syntéza esterů), od reakční směs destilovat (destilovat) vodu. Prostřednictvím speciálních studií s použitím značených atomů bylo možné prokázat, že během procesu syntézy se atom O, který je součástí výsledné vody, oddělí od kyseliny (označeno červeným tečkovaným rámečkem), a nikoli od alkoholu ( nerealizovaná možnost je zvýrazněna modrým tečkovaným rámečkem).
Za použití stejného schématu se získají estery anorganických kyselin, například nitroglycerin (obr. 5B). Místo kyselin lze použít chloridy kyselin, metoda je použitelná jak pro karboxylové (obr. 5C), tak pro anorganické kyseliny (obr. 5D).
Interakce solí karboxylových kyselin s alkylhalogenidy
RCl vede také k esterům (obr. 5D), reakce je výhodná v tom, že je nevratná, uvolněná anorganická sůl je okamžitě odstraněna z organického reakčního prostředí ve formě sraženiny.Použití esterů. Ethylformiát HCOOC 2 H 5 a ethylacetát H 3 COOC 2 H 5 se používají jako rozpouštědla pro celulózové laky (na bázi nitrocelulózy a acetátu celulózy).Estery na bázi nižších alkoholů a kyselin (tabulka 1) se používají v potravinářském průmyslu k tvorbě ovocných esencí a estery na bázi aromatických alkoholů v parfémovém průmyslu.
Z vosků se vyrábějí leštidla, maziva, impregnační směsi na papír (voskovaný papír) a kůži, dále jsou součástí kosmetických krémů a léčivých mastí.
Tuky spolu se sacharidy a bílkovinami tvoří soubor potravin nezbytných pro výživu, jsou součástí všech rostlinných a živočišných buněk, navíc při jejich hromadění v těle plní roli energetické rezervy. Tuková vrstva díky své nízké tepelné vodivosti dobře chrání živočichy (zejména mořské velryby nebo mrože) před podchlazením.
Živočišné a rostlinné tuky jsou surovinou pro výrobu vyšších karboxylových kyselin, čistící prostředky a glycerin (obr. 4), používaný v kosmetickém průmyslu a jako složka různých lubrikantů.
Nitroglycerin (obr. 4) je známá droga a výbušnina, základ dynamitu.
Vysoušecí oleje se vyrábějí z rostlinných olejů (obr. 3), které tvoří základ olejových barev.
Estery kyseliny sírové (obr. 2) se používají v organické syntéze jako alkylační (zavedení alkylové skupiny do sloučeniny) činidla a estery kyseliny fosforečné (obr. 5) se používají jako insekticidy a také přísady do mazacích olejů.
Michail Levický
LITERATURA Kartsova A.A. Dobývání hmoty. Organická chemie. Nakladatelství Khimizdat, 1999Pustovalová L.M. Organická chemie. Phoenix, 2003
Nomenklatura
Názvy esterů jsou odvozeny od názvu, uhlovodíkového radikálu a a názvu kyseliny, ve které je místo koncovky „kyselina -ová“ použita přípona „at“ (jako u názvů anorganických solí: uhličitan sodný, dusičnan chromitý), například:

(Fragmenty molekul a odpovídající fragmenty jmen jsou zvýrazněny stejnou barvou.)
Estery jsou obvykle považovány za reakční produkty mezi kyselinou a alkoholem; například butylpropionát lze považovat za výsledek reakce mezi kyselinou propionovou a butanolem.
Pokud se použije triviální název výchozí kyseliny, pak je v názvu sloučeniny zahrnuto slovo „ester“, například C 3 H 7 COOC 5 H 11 - amylester kyseliny máselné.
Homologní série

izomerismus
Estery se vyznačují třemi typy izomerie:
1. Isomerie uhlíkového řetězce, začíná na kyselém zbytku s kyselinou máselnou, na alkoholovém zbytku - s propylalkoholem, například:
2. Isomerie polohy esterové skupiny -CO-O-. Tento typ izomerie začíná estery, jejichž molekuly obsahují alespoň 4 atomy uhlíku, například:
3. Mezitřídní izomerie, estery (alkylalkanoáty) jsou izomerní k nasyceným monokarboxylovým kyselinám; Například:
Pro estery obsahující nenasycenou kyselinu nebo nenasycený alkohol jsou možné další dva typy izomerie: izomerie polohy násobné vazby; cis-trans izomerie.
Fyzikální vlastnosti
Estery nižších homologů kyselin a alkoholů jsou bezbarvé, nízkovroucí kapaliny s příjemnou vůní; používá se jako aromatické přísady potravinářské výrobky a v parfumerii. Estery se špatně rozpouštějí ve vodě.
Způsoby získávání
1. Extrahováno z přírodních produktů
2. Interakce kyselin s alkoholy (esterifikační reakce); Například:

Chemické vlastnosti
1. Nejtypičtější reakce pro estery jsou kyselá nebo alkalická hydrolýza (zmýdelnění). Jedná se o reakce, které jsou opakem esterifikačních reakcí. Například:

2. Redukce (hydrogenace) komplexních etherů, v důsledku čehož vznikají alkoholy (jeden nebo dva); Například: